Эпидуральная анестезия и продленная эпидуральная анестезия
Еще фото
Автор (ы): Ю.С. Дородных, ветеринарный врач анестезиолог-реаниматолог сети ветеринарных клиник «Белый клык», преподаватель образовательного центра Коллегии ветеринарных специалистов, Москва
Журнал: №4-2017
УДК 619:616-089.5
В статье описана техника проведения эпидуральной анестезии у мелких домашних животных, необходимые препараты и осложнения.
Ways of performing epidural analgesia in small animal veterinary medicine, complications and regional anesthetics are described in this article
История использования нейроаксиальной блокады начинается в конце XIX в., когда доктор J.L. Corning в 1885 г. проводил опыты по введению кокаина в межостистые промежутки, однако не было установлено, была ли вызвана спинальная (субдуральная) или эпидуральная анестезия [1]. Со временем методы нейроаксиальных блокад (спинальная, эпидуральная и комбинированная техника) стали получать все большее распространение, чему способствовали появление новых препаратов и развитие техники их выполнения.
На сегодняшний день методики регионарной анестезии, включая эпидуральную и продленную эпидуральную анестезию, являются одним из компонентов мультимодальной анальгезии – концепции, предложенной H. Kehlet и J.B. Dahl в 1993 г. [2], направленной на максимально эффективный и безопасный для пациента контроль боли.
Анатомическое обоснование
Знание анатомии спинного мозга и позвоночника является важным для практикующего анестезиолога, для понимания своих действий при проведении эпидуральной и спинальной анестезии и интерпретации данных, полученных при этих манипуляциях.
Спинномозговой канал образован последовательно соединенными позвонковыми отверстиями, межпозвонковыми связками, желтой связкой и твердой мозговой оболочкой. Субдуральными структурами (интратекальными) являются спинной мозг, паутинная и мягкая мозговые оболочки, а также спинномозговая жидкость. От спинного мозга отходят две пары спинномозговых корешков. Дорсальные корешки спинного мозга образованы афферентными волокнами (сенсорными), а вентральные корешки – эфферентными волокнами (моторными). В области слияния дорсального и вентрального корешка в спинномозговой нерв твердая мозговая оболочка становится тоньше и более проницаема. Именно корешки спинного мозга, за счет истончения твердой мозговой оболочки, являются точкой приложения препаратов, используемых для эпидуральной анестезии.
Спинной мозг проходит через позвоночный канал от большого затылочного отверстия до 6–7 поясничного позвонка, где далее образует структуру, называемую conus medullaris и представляющую собой группу нервных волокон, заключенных в твердую мозговую оболочку. Далее conus medullaris продолжает сужаться, образуя в конечном итоге концевую нить (filum terminale), доходящую до первых хвостовых позвонков [3, 4]. Знание этих анатомических особенностей необходимо для лучшего понимания техники выполнения эпидуральной анестезии.
Фармакодинамика
Как было сказано ранее, точкой приложения препаратов, используемых для эпидуральной анестезии, являются корешки спинного мозга, где твердая мозговая оболочка становится более проницаемой для этих веществ.
Классически для проведения регионарной анестезии используются местные анестетики, однако уже давно эта группа препаратов не является единственной. Наряду с местными анестетиками, для введения в эпидуральное и спинальное пространство используются препараты других групп, таких как опиоидные анальгетики и альфа-2-агонисты.
Механизм действия местных анестетиков основан на блокаде потенциалзависимых натриевых каналов, которая подавляет возможность генерации потенциала действия. Развитие блокады натриевых каналов будет происходить в следующей последовательности: повышение порога возбуждения, снижение скорости возникновения потенциала действия, снижение амплитуды потенциалов действия, далее исчезает способность генерировать потенциал действия.
Местные анестетики способны вызывать блокаду любых нервов, однако скорость возникновения и распространения блока будет зависеть от толщины нервного волокна и наличия или отсутствия миелиновой оболочки. Данное явление дает понять, почему ноцицептивный блок при проведении эпидуральной анестезии возникает прежде, чем моторный. Это происходит в связи с тем, что ноцицептивные волокна имеют меньший диаметр (волокна типа Аδ – 2–5 мкм, волокна типа С– 0,4–1,2 мкм), чем моторные волокна (волокна типа Аα – 12–20 мкм) [5].
Обоснованием для использования при эпидуральной анестезии опиоидных анальгетиков и альфа-2-агонистов является наличие большого количества этих рецепторов в дорсальных корешках спинного мозга.
Опиоидные анальгетики, подобно эндогенным опиоидам (эндорфинам, динорфинам, энкефалинам), связываются с опиоидными рецепторами дорсальных корешков, блокируя проведения ноцицептивного импульса. Подобным же образом действуют и альфа-2-агонисты (например, дексмедетомидин): связываясь каждый со своим специфическим рецептором, вызывают блокаду ноцицептивного импульса [6].
Использование этих препаратов позволяет добиться хорошей анальгезии без возникновения моторного блока и миорелаксации, что важно для продленной эпидуральной анестезии у пациентов ОРИТ.
Помимо опиоидных анальгетиков и а-2-агонистов, встречается упоминание об использовании золетила для эпидурального введения у лошадей [20], однако широкого распространения введение золетила эпидурально в ветеринарии мелких домашних животных пока не получило.
Также препарат маропитант, несмотря на механизм действия, который может предполагать у него анальгетическую активность, не получил пока доказательной базы для его использования при эпидуральной анестезии [21]. В связи с этим пока нельзя рекомендовать использовать его в качестве препарата для эпидуральной анестезии.
Техника пункции эпидурального пространства
Наиболее часто для проведения эпидуральной анестезии используется люмбосакральный доступ (L7–S1). При выполнении этой техники анестезиолог имеет хорошие анатомические ориентиры для введения иглы, а также невысокие риски травмы спинного мозга, поскольку, как было сказано выше, на этом уровне уже нет спинного мозга, и содержимым спинномозгового канала является filum terminale.
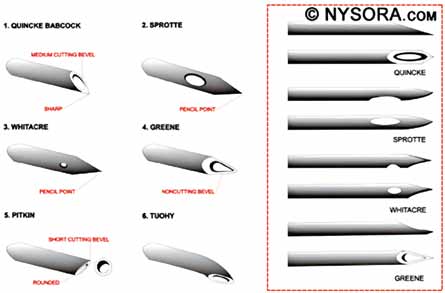
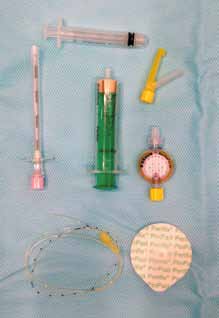
Для пункции эпидурального пространства применяют спинальные иглы со срезом типа Quincke или Pencil point (Sprotte), а также иглы типа Tuohi для установки ЭК (рис. 1), но могут использоваться и другие типы. Часто врачи пользуются обычными иглами сечения 22–20 G, размер иглы выбирается субъективно, исходя из размеров пациента. Однако предпочтительнее использовать специальные иглы, так как они наносят меньшую травму тканям при пункции и более удобны в использовании.
Положение пациента при выполнении пункции эпидурального пространства может быть стернальным или боковым. Во многом это зависит от предпочтений и опыта анестезиолога, по мнению автора статьи, положение пациента на животе более выгодное и позволяет лучше определить анатомические ориентиры.
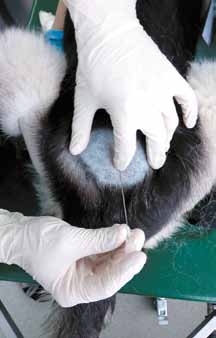
Перед проведением процедуры необходимо подготовить операционное поле: сбрить шерсть и обработать кожу раствором антисептика. Во многих руководствах также рекомендуют проводить процедуру, накрыв пациента стерильной пеленкой с вырезом в области пункции и в стерильных перчатках.
После подготовки поля, расходных материалов, включающих в себя иглы, раствор анестетика, набранный в шприц, шприц с раствором для проведения теста с потерей сопротивления, а также после антисептической обработки рук анестезиолога можно приступать к выполнению процедуры.
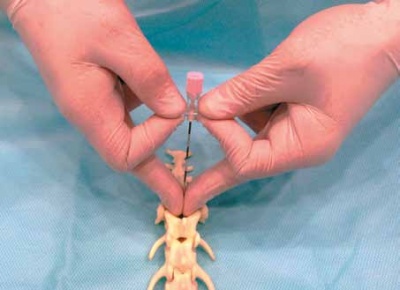
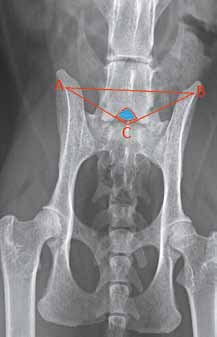
Определяется положение люмбосакрального сочленения, для этого используются анатомические ориентиры, представленные крыльями подвздошных костей, позвонками L6, L7 и S1.
Точки, являющиеся верхушками подвздошных костей и остистого отростка позвонка S1, образуют перевернутый равнобедренный треугольник, ближе к вершине которого располагается люмбосакральное сочленение (рис. 2). Пальпаторно люмбосакральное сочленение будет восприниматься как «провал» между L7 и S1. Дополнительными ориентирами могут служить остистые отростки позвонков L6 и L7. Остистый отросток позвонка L6 выше, чем остистый отросток позвонка L7.
После определение ориентиров проводится пункция эпидурального пространства. Игла фиксируется большим и указательным пальцами рабочей руки, второй рукой оцениваются анатомические ориентиры или удерживается ось иглы.
После пункции проводятся тесты для подтверждения ее положения в эпидуральном пространстве.
Аспирационный тест выполняется оттягиванием поршня шприца на себя и может подтвердить непреднамеренную сосудистую пункцию (вена или артерия). В случае появления в шприце или его канюле крови необходимо вытащить иглу и провести пункцию повторно или отказаться от эпидуральной анестезии. Введение препаратов в случае положительного аспирационного теста недопустимо.
Тест с потерей сопротивления является субъективным и оценивает легкость введения раствора в эпидуральное пространство, раствор должен идти легко. Если раствор приходится вводить с усилием, то велика вероятность, что игла находится не в эпидуральном пространстве. Для получения более достоверной информации от этого теста возможно использование шприцев, имеющих низкое сопротивление ходу поршня (когда поршень легко скользит внутри шприца).
Тест с пузырьком воздуха выполняется следующим образом. В шприц с раствором набирается небольшой объем воздуха для получения пузырька. Далее шприц соединяется с иглой, и начинает вводиться раствор. При пункции эпидурального пространства пузырек не должен сжиматься более чем на 50%.
Тест с «висячей каплей» также позволяет определить положение иглы в эпидуральном пространстве. Поскольку давление в эпидуральном пространстве ниже атмосферного (-5 – -15 рт.ст.), капля раствора, помещенного в канюли иглы, должна всосаться в иглу при попадании в эпидуральное пространство. Однако у мелких собак и кошек этот эффект может и не наблюдаться.
Техника катетеризации эпидурального пространства
Исследования показывают, что техника продленной эпидуральной анестезии с использованием ЭК является эффективным компонентом мультимодальной анальгезии и рекомендована к использованию международной ассоциацией ветеринарии мелких домашних животных [8, 9, 10]. Данная методика может быть особенно полезна в условиях отсутствия свободного доступа к опиоидным анальгетикам. Продленная эпидуральная анестезия позволяет добиваться хорошего контроля боли у пациентов с абдоминальной болью (панкреатит, перитонит), травмами и массивными переломами таза и тазовых конечностей. Также можно применять ее для обезболивания грудной клетки, однако такое применение более редкое, данные по применению у животных ограничены.
Для установки ЭК используются, как правило, готовые наборы, которые включают в себя иглу Tuohi, ЭК, бактериальный фильтр и коннектор типа Люэр, а также шприц для теста с потерей сопротивления (рис. 3).
Учитывая риск инфицирования эпидурального пространства у пациентов с ЭК (2,4% по Swalander [11]), рекомендовано тщательное соблюдение асептики при установке ЭК, процедура должна проводиться в условиях стерильной операционной.
После подготовки поля и антисептической обработки определяются ориентиры для пункции эпидурального пространства. Обычно используют люмбосакральный доступ, как при обычной эпидуральной анестезии. Когда определены ориентиры для пункции эпидурального пространства, анестезиолог ориентирует иглу Туохи (имеет однонаправленный срез для введения катетера) срезом в краниальном направлении, именно в эту сторону будет вводиться ЭК. Игла Туохи снабжена специальными «крылышками» и имеет специфический хват для ее введения. Указательными и большими пальцами обеих рук игла фиксируется за «крылышки» с двух сторон, средние пальцы находятся у места пункции и удерживают ось иглы. Введение иглы осуществляется давлением на «крылышки» (Рис. 4). После пункции эпидурального пространства проводятся тесты, описанные выше, для подтверждения положения иглы.
Далее через адаптер, входящий в набор, в эпидуральное пространство вводится катетер. Очень важно помнить, что катетер может двигаться только вперед, при попытке вывести катетер через иглу назад может произойти его пересечение иглой, что приведет к тому, что фрагмент катетера останется в эпидуральном пространстве. Кончик катетера должен располагаться в нескольких сантиметрах от предполагаемого места блокады, что важно для эффективного распространения препарата. После удаления иглы к катетеру подсоединяется бактериальный фильтр, заполненный раствором, для снижения объема воздуха, попадающего в эпидуральное пространство. Затем катетер фиксируется к коже с помощью специальных фиксаторов и клеящихся повязок (обычно входят в готовый набор для установки ЭК). Подшивание катетера обычно не проводят. Также сверху можно наложить повязку с помощью самофиксирующего бинта для дополнительной защиты катетера.
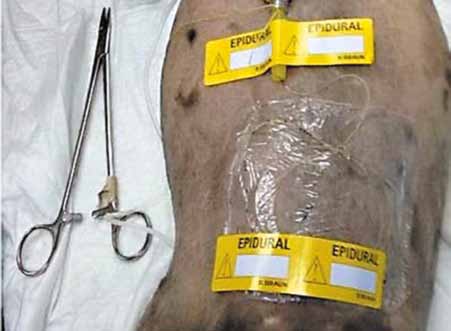
Несмотря на то, что рентгеноконтрастное исследование не является рутинной практикой после установки ЭК, автор статьи использует этот метод диагностики для подтверждения положения ЭК в эпидуральном пространстве, а также для оценки его латерализации относительно спинного мозга (рис. 5).
Препараты для эпидуральной анестезии
Растворы местных анестетиков будут отличаться по продолжительности своего действия.
В ветеринарной практике чаще всего используются три препарата из группы местных анестетиков: лидокаин, бупивакаин и ропивакаин. Рекомендуемые дозы препаратов и продолжительность их действия суммированы в представленной таблице 1.
Таблица 1. По данным BSAVA Manual of canine and feline anaesthesia and analgesia. Second edition. C. Seymour, T. Duke-Novakovski. 2007. Small Animal Regional Anesthesia and Analgesia. L. Campoy, M.R. Read. Wiley-Blackwell? 2013
|
Препарат |
Время начала действия, мин |
Продолжительность моторного блока, мин |
Продолжительность сенсорного блока, мин |
Дозировка, мг/кг |
|
Лидокаин 2% |
5 |
120 |
120 |
4,4 |
|
Бупивакаин 0,5% |
10–20 |
240–360 |
до 360 |
0,5 |
|
Ропивакаин 0,75% |
10–20 |
100 |
140 |
0,22 |
При использовании местных анестетиков короткого действия, в частности лидокаина, возможно использование адъювантов, призванных продлить и усилить его действие.
Для продления эффектов лидокаина в качестве адъюванта обычно применяют раствор адреналина гидрохлорида. За счет локальной вазоконстрикции снижается всасывание лидокаина в системный кровоток из эпидурального пространства, а следовательно, время действия лидокаина увеличивается. С другой стороны, из-за того же эффекта увеличивается время начало действия лидокаина. Адреналин добавляется из расчета 5 мкг/мл раствора лидокаина [1].
Для ускорения начала действия и увеличения эффективности анальгезии при эпидуральной блокаде используется раствор натрия гидрокарбоната из расчета 0,1 мл натрия гидрокарбоната на 1 мл раствора лидокаина [15]. Механизм этого эффекта основан на переходе ионизированной формы лидокаина, которая содержится в растворе, в неионизированную за счет повышения рН раствора. Именно неионизированная форма взаимодействует с мембраной нейрона и вызывает блокаду.
Однако более надежно и удобно сразу использовать анестетики более длительного действия, если время хирургического вмешательство может быть больше, чем время действия лидокаина.
Не менее важным фактором, определяющим эффективность эпидуральной анестезии, кроме дозировки анестетика, будет его объем, введенный в эпидуральное пространство. Именно объем анестетика будет определять «место работы» анестетика. Таким образом, для анальгезии тазовых конечностей будет требоваться меньший объем анестетика, чем для обезболивания поджелудочной железы.
По данным, приведенным Lee et al., 2004, видна прямая корреляция между объемом вводимого раствора и высотой распределения. В исследовании использовался люмбосакральный доступ. Данные, полученные в результате исследования, приведены в таблице 2.
Таблица 2. По данным Lee I., Yamagishi N., Oboshi K. et al., 2004 [13
|
Объем раствора метиленового синего |
Уровень распространения |
|
0,1 мл/кг |
L3–L4 |
|
0,2 мл/кг |
L1–L2 |
|
0,3 мл/кг |
T7–T11 |
|
0,4 мл/кг |
T6–T10 |
Таким образом, врач должен принять решение, какой объем анестетика необходим данному пациенту (до какого уровня хотим обезболить), далее развести нужно количество, мг, препарата в этом объеме.
В гуманной, а также в зарубежной ветеринарной медицине широко распространено введение в эпидуральное пространство опиоидных анальгетиков, которые, связываясь с опиоидными рецепторами в дорсальных корешках, обеспечивают эффективную анальгезию без моторного блока и системных побочных эффектов. Помимо хорошего сенсорного блока, введение опиоидных анальгетиков при проведении эпидуральной анестезии позволяет снизить потребность в местных анестетиках, вводимых эпидурально, что важно для снижения их побочных эффектов.
Как было сказано выше, помимо опиоидных анальгетиков, эпидурально можно вводить α-2-адреноагонисты, тем более, что существуют данные о сопоставимости уровня анальгезии при использовании дексмедетомидина и морфина с уровнем анальгезии местными анестетиками [14].
Данные по дозировкам α-2-адреноагонистов и опиоидов приведены в таблице 3.
Таблица 3. По данным Small Animal Regional Anesthesia and Analgesia. L.Campoy, M.R. Read. Wiley-Blackwell. 2013
|
Препарат |
Начало действия, мин |
Время действия, ч
|
Дозировка, мг/кг |
|
Морфина гидрохлорид |
30–60 |
6–24 |
0,1 |
|
Метадон |
30–40 |
8–12 |
0,3 |
|
Буторфанол |
10–20 |
3–4 |
0,25 |
|
Фентанил |
15–20 |
3–5 |
5–10 |
|
Медетомидин |
20–30 |
2–6 |
5–10 |
|
Дексмедетомидин |
20–30 |
4–6 |
1–2 |
Отдельно стоит рассказать об использовании инфузии с постоянной скоростью (ИПС) препаратов в ЭК. Эта методика позволяет добиваться хорошей анальгезии без пиков снижения и повышения концентрации анестетика в эпидуральном пространстве, что важно для поддержания постоянного уровня анальгезии и снижения эффектов, связанных с болюсным введением препаратов (перераспределение объема циркулирующей крови (ОЦК)). Рекомендованная скорость, с которой в эпидуральное пространство вводятся препараты, 0,02–0,05 мл/кг/ч [3].
При продленной эпидуральной анестезии может быть более безопасным использовать ропивакаин (ниже риск побочных эффектов). Также можно использовать сочетание ропивакаина и дексдомитора. Применение α-2-агонистов эпидурально может быть оправдано при плохой переносимости препаратов для регионарной анестезии или если в монорежиме они не достаточно эффективны.
Осложнения эпидуральной анестезии и препаратов для эпидуральной анестезии
Обсуждая осложнения, связанные с использованием эпидуральной анестезии, важно разделить понятия «осложнения» и «физиологические эффекты».
Как отмечают литературные источники и врачи-анестезиологи, гипотония – самое частое нежелательное явление после проведения эпидуральной анестезии, однако осложнением это не является, а представляет собой физиологический ответ на использование местных анестетиков. При введении местных анестетиков эпидурально или субдурально возникает блокада симпатических волокон, иннервирующих сосудистую систему, по сути, возникает симпатэктомия, в результате которой снижается тонус сосудов и в первую очередь вен, в которых заключено до 75% ОЦК [6]. В результате веноплегии происходит перераспределение объема крови и снижается преднагрузка, что в итоге и может привести к снижению артериального давления.
В связи с этим ранее существовали рекомендации проводить инфузионную подготовку перед эпидуральной анестезией, однако этот метод неэффективен и не позволяет профилактировать гипотонию. При развитии значимой гипотензии инфузионная терапия тоже не будет эффективной, поскольку механизм снижения артериального давления в этом случае не связан с дефицитом жидкости в сосудах. Поэтому основной способ коррекции гипотензии, возникшей на фоне эпидуральной анестезии, – применение препаратов, способных восстановить тонус сосудов и устранить вазодилатацию, например, неселективный адреноагонист – эфедрин [1], однако учитывая сложности с оборотом этого препарата, препаратом первого выбора будет являться норадреналин [22]. На степень гипотонии при использовании эпидуральной анестезии будут влиять несколько факторов, таких как степень волемии пациента, его возраст, изначальная тяжесть состояния. Разумеется, если у пациента есть гиповолемия, риск развития гипотензии будет гораздо выше, поэтому в таком случае необходимо восполнить пациенту дефицит жидкости с помощью инфузионной терапии до проведения эпидуральной анестезии. Предсказать степень гипотонии в каждом конкретном случае не представляется возможным. Однако это осложнение не является очень частым и легко обратимо в большинстве случаев, если врач готов к нему. Поэтому страх перед гипотензией не должен заставлять нас отказываться от эпидуральной анестезии.
Также одним из осложнений может являться непреднамеренная пункция твердой мозговой оболочки. В таком случае, мы выполняем не эпидуральную, а спинальную анестезию. При пункции твердой мозговой оболочки в канюле иглы появляется ликвор. Дозы препаратов для спинальной анестезии в два раза меньше, чем для эпидуральной, поэтому можно передозировать анестетик. Если есть подозрение, что была пунктирована твердая мозговая оболочка, необходимо уменьшить дозу вводимого препарата в два раза или вытащить иглу и повторить попытку позже. Это не частое осложнение, т.к. в области пункции обычно нет спинного мозга. Риск этого осложнения выше у щенков и котят, так как у них спинной мозг может быть расположен более каудально.
К основному истинному осложнению эпидуральной анестезии можно отнести непреднамеренное внутрисосудистое введение препаратов или случайную передозировку. В этом случае будут развиваться системные эффекты препаратов, со всеми вытекающими побочными эффектами. При внутрисосудистом введении местных анестетиков будут развиваться эффекты, связанные, в первую очередь, с их нейро- и кардиотоксичностью, что может привести к нарушению ритма и остановке сердца. Из перечисленных выше препаратов группы местных анестетиков наиболее значимой кардиотоксичностью обладает бупивакаин, который подавляет проводящую систему сердца, что приводит к асистолии с плохим реанимационным прогнозом [4, 7, 16].
Нейротоксичность местных анестетиков при внутрисосудистом введении будет проявляться судорогами. Что интересно, плазменная концентрация, при которой будет проявляться нейротоксичность местных анестетиков, в 4–7 раз меньше, чем концентрация, при которой будет проявляться кардиотоксичность [17]. В случае развития эпилептиформных приступов из-за внутрисосудистого введения местных анестетиков, необходимо добиться их купирования, исходя из принятых алгоритмов борьбы с судорожным синдромом и эпистатусом.
В настоящее время эффективным антидотом для борьбы с побочными эффектами местных анестетиков является раствор липидов [23, 24]. При появлении системных токсических эффектов анестетиков вводится болюс 20% раствора липидов 1,5 мл/кг (или 3 мл/кг, если раствор 10%), далее ставят инфузия 20% липида со скоростью 15 мл/кг/ч (или 30 мл/кг ч для 10% раствора). Если тяжелые побочные эффекты не прошли, то через 5 мин можно повторить болюс 1,5 мл/кг (не более трех болюсов суммарно) и увеличить скорость инфузии с постоянной скоростью в два раза. Липиды можно и нужно вводить во время проведения сердечно-легочной реанимации, если из-за введения местных анестетиков произошла остановка сердца. Это повышает шансы на спасение пациента. Введение липидов прекращают, если пациент получил 12 мл/кг 20% раствора или раньше, если симптомы прошли. В качестве раствора липидов используются стандартные липидные растворы для парентерального питания (интралипид, липофундин и другие). Стоит отдельно подчеркнуть, что препарат пропофол, хотя и содержит липиды, не подходит для применения как антидот, поскольку содержание жиров в нем недостаточное, помимо этого, могут усугубиться побочные эффекты из-за действия самого пропофола.
Также одним из редких осложнений является высокий блок – если выбран слишком большой объем анестетика. В таком случае может развиться паралич дыхательных мышц, который требует искусственной вентиляции легких до прекращения действия анестетика. Помимо этого, при высоком блоке может возникнуть гипотензия, требующая введения норадреналина.
Помимо описанных выше эффектов, при использовании ЭК в ветеринарной периодике встречается одно упоминание транзиторного синдрома Горнера [18], который не требовал специфического лечения и саморазрешался. В нашей практике мы сталкивались с этим осложнением единожды. Несмотря на низкую распространенность этого осложнения в ветеринарии, в гуманной анестезиологии частота встречаемости транзиторного синдрома Горнера составляет 1,4% и ассоциируется с проведением эпидуральной и спинальной анестезии на уровне грудных сегментов спинного мозга [19].
Противопоказания
Все противопоказания к использованию эпидуральной анестезии можно отнести к относительным, что будет требовать от анестезиолога соотнести риск/пользу для пациента. К относительным противопоказаниям можно отнести следующие: коагулопатия (риск развития субдуральных и эпидуральных гематом), инфекция кожи в области пункции (контаминация эпидурального пространства), гиповолемия (риск выраженной гипотонии), низкий опыт анестезиолога и недостаточная теоретическая подготовка, плохое аппаратное и материальное обеспечение (реанимационный набор, рентген и т.д.).
Заключение
Методы регионарной анестезии, в частности эпидуральная блокада, являются важными инструментами анестезиолога, способными обеспечить хороший уровень анальгезии, снизить потребность в системных анальгетиках и добиться хорошего контроля боли в ОРИТ. Частота возникновения осложнений и их выраженность во многом будут зависеть от места пункции эпидурального пространства. Выше рассматривалась классическая эпидуральная пункция в области люмбосакрального сочленения.
Пренебрежение методами регионарной анестезии способно осложнить работу анестезиолога и ухудшить качество лечения пациентов.
Литература
1. Миллер Р. Анестезия. Руководство в четырех томах. ". СПб.: Человек, 2015.
2. Kehlet H., Dahl J. The Value of «Multimodal» or «Balanced Analgesia» in Postoperative Pain Treatment.. Anesth Analg, 1993.
3. Small Animal Regional Anesthesia and Analgesia. L.Campoy, M.R.Read. Wiley-Blackwell. 2013.
4. Малрой М. Местная анестезия. М.: Бином, 2005.
5. Катцунг Б.Г. Базисная и клиническая фармакология. . 2-е издание. М: Бином, 2007.
6. Медицинская физиология. А.К. Гайтон, Д.Э.Холл. М.: Логосфера, 2008.
7. Клиническая анестезиология. Дж.Э.Морган-мл., М.С.Михаил, М.Дж. Марри. 4-е издание. М.: Бином, 2014.
8. Hansen B.D. Epidural Catheter Analgesia in Dogs and Cats: Technique and Review of 182 Cases (1991–1999).. Journal of veterinary emergency and critical care. 2001; 2.
9. Evaluation of complications and feasibility of indwelling epidural catheter use for post-operative pain control in dogs in the home environment. L.R. Phillips , K.P. McAbee , N. Stephenson , N.J. Stanke , M.L. Booms & D.D. Degner. New Zealand Veterinary Journal . 2014.
10. Guidelines for recognition, assessment and treatment of pain WSAVA. K.Mathews, P.W. Kronen, D.Lascelles, A.Nolan , S. Robertson. 2014.
11. Complications associated with the use of indwelling epidural catheters in dogs: 81 cases (1996–1999). D.B. Swalander, D.T. Crowe, Jr, D.H. Hittenmiller, P. Jahn. JAVMA, 2000.
12. BSAVA Manual of canine fnd feline anaesthesia and analgesia. Second edition. C. Seymour, T. Duke-Novakovski. 2007.
13. Lee I., Yamagishi N., Oboshi K. et al. Distribution of new methylene blue injected into the lumbosacral epidural space in cats Vet Anaesth Analg. 2004.
14. Smith O. A comparison of epidural analgesia provided by bupivacaine alone, bupivacaine + morphine, or bupivacaine + dexmedetomidine for pelvic orthopedic surgery in dogs. Vet Anaesth Analg. 2013.
15. Curatolo M., Petersen-Felix S., Arendt-Nielsen L., Lauber R., Hogstrom H., Scaramozzino P.,
Luginbiihl M., Sieber T. J., Zbinden A.M. Adding Sodium Bicarbonate to Lidocaine Enhances the Depth of Epidural Blockade.
Anesth Analg. 1998.
16. Covino M.R. Cardiac electrophysiologic properties of bupivacaine and lidocaine compared with those of ropivacaine, a new amide local anesthetic. . Anesthesiology. 1990.
17. Liu P.L., Feldman H.S., Giasi R., et al. Comparative CNS toxicity of lidocaine, etidocaine, bupivacaine, and tetracaine in awake dogs following rapid intravenous administration. Anesth Analg. 1983.
18. Bosmans T., Schauvliege S., Gasthuys F., Marcilla M.G., Polis I. Transient unilateral Horner's syndrome after epidural ropivacaine in a dog.
Vet Anaesth Analg. 2009.
19. Park S.Y., Chun H.R., Kim M.G., Lee S.J., Kim S.H., Ok S.Y., Cho A. Transient Horner's syndrome following thoracic epidural anesthesia for mastectomy: a prospective observational study. Can J Anaesth. 2015.
20. Natalini C.C., Alves S.D., Guedes A.G., Polydoro A.S., Brondani J.T., Bopp S. Epidural administration of iletamine/zolazepam in horses. Vet Anaesth Analg. 2004.
21. Alvillar B.M., Boscan P., Mama K.R., Ferreira T.H., Congdon J., Twedt D.C. Effect of epidural and intravenous use of the neurokinin-1 (NK-1) eceptor antagonist maropitanton the sevoflurane minimum alveolar concentration (MAC) in dogs. Vet Anaesth Analg. 2012.
22. Mohamed M El Shafei, Hanaa A El Gendy, Dalia M El Fawy orepinephrine versus ephedrine for the prevention of spinal anesthesia-induced hypotension in coronary artery disease patients undergoing knee arthroscopy.. Ains Shams Journal of Anesthesiology, 201523. Anesthesiol Res Pract. 2012 Lipid Emulsion for Local Anesthetic Systemic Toxicity Sarah Ciechanowicz and Vinod Patil.
24. AAGBI Safety Guideline Management of Severe Local Anaesthetic Toxicity.


Назад в раздел

















