Хирургическое лечение аппендикулярной остеосаркомы у собак на основании трех клинических случаев. Выбор метода при замещении пострезекционных костных дефектов
Еще фото
Автор (ы): С.С. Горшков (gorschkov.vet@gmail.com), Н.В. Уланова (vet.best@mail.ru), Е.М. Козлов, В.В. Мануйлова, Е.И. Петрова
Организация(и): Ветеринарная клиника «Бэст» (Новосибирск)
Журнал: №3 - 2018
Отчаянные болезни требуют отчаянных средств
Hippocrates
Ключевые слова: мелкие домашние животные, органосохранные операции, остеосаркома, 3D-печать, индивидуальные хирургические позиционные направители (гайды)
Key words: mall pets, organ-preserving surgeries, osteosarcoma, 3-dimensional, individual surgical positioners
Сокращения:
НО – новообразования; ОС — остеогенная саркома (остеосаркома); ОСО – органосохранная операция; LCP — locking compression plate (блокирующаяся компрессионная пластина);
LС-DCP (Limited Contact Dynamic Compression Plate) – динамическая компрессионная пластина ограниченного контакта; БИОС - блокируемый интрамедуллярный остеосинтез;
МРТ — магнитно-резонансная томография; КТ – компьютерная томография; НПВС — нестероидные противовоспалительные средства;
ОМЖ – опухоль молочной железы; ПКК – плоскоклеточная карцинома; ОГЭ – овариогистерэктомия; МТ – метастазы (метастатические поражения);
аКЦО – армированный костно-цементный остеосинтез; аКЦП – армированный костно-цементный протез (эндопротез); ПММА – полиметилметакрилат (костный цемент);
3D (от англ.: 3-dimensional – трехмерная модель, 3D-моделирование, 3D-печать, 3D-печать металлом) – общее название технологий аддитивного производства металлических изделий;
SLS (Selective Laser Sintering) – выборочное лазерное спекание; SLM (Selective Laser Melting) – выборочная лазерная плавка; FDM (Fused Deposition Modeling) – моделирование методом послойного наплавления;
ABS-пластик – акрилонитрилбутадиенстирол (АБС); DICOM-файл (DICOM File) – медицинский отраслевой стандарт создания, хранения, передачи и визуализации цифровых медицинских изображений и документов обследованных пациентов;
ПХН – позиционный хирургический направитель (синоним: хирургический направляющий шаблон (гайд); в литературе также упоминается как прецизионный персонифицированный (индивидуальный) направитель (ППН).
ПЭТ или ПЭТ/КТ – позитронная эмиссионная томография
Аннотация
В данной статье представлены 3 хирургические техники по реконструкции пострезекционных костных дефеков (пРКД) после органосохранных операций (ОСО) при аппендикулярной остеосаркоме на основании 3-х клинических случаев. Рассмотрены особенности хирургических техник с реконструкцией пРКД костным цементом (ПММ) армированным интрамедуллярными спицами Киршнера (армированный костно-цементный остеосинтез – аКЦО) с последующей фиксацией сегментов кости LCP+LC-DCP пластинами; техника реконструкции пРКД с использованием индивидуального эндопротеза, изготовленного методом 3D-печати с использованием аддитивных технологий и техника реконструкции с использованием системы БИОС. Представлены особенности выполняемых хирургических техник и клинические рекомендации с оценкой преимуществ, недостатков и осложнений данных методов.
Общие данные. Эпидемиология
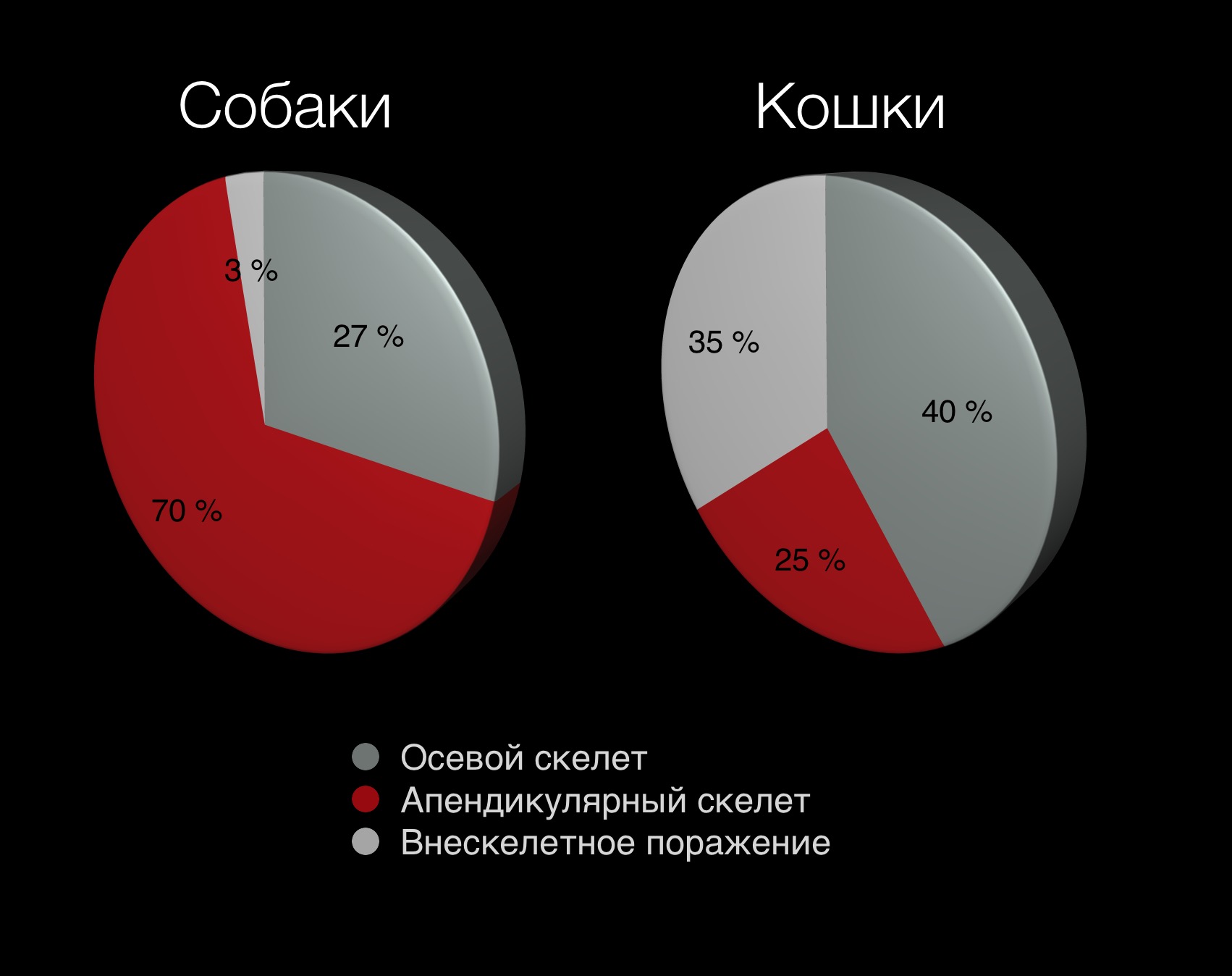
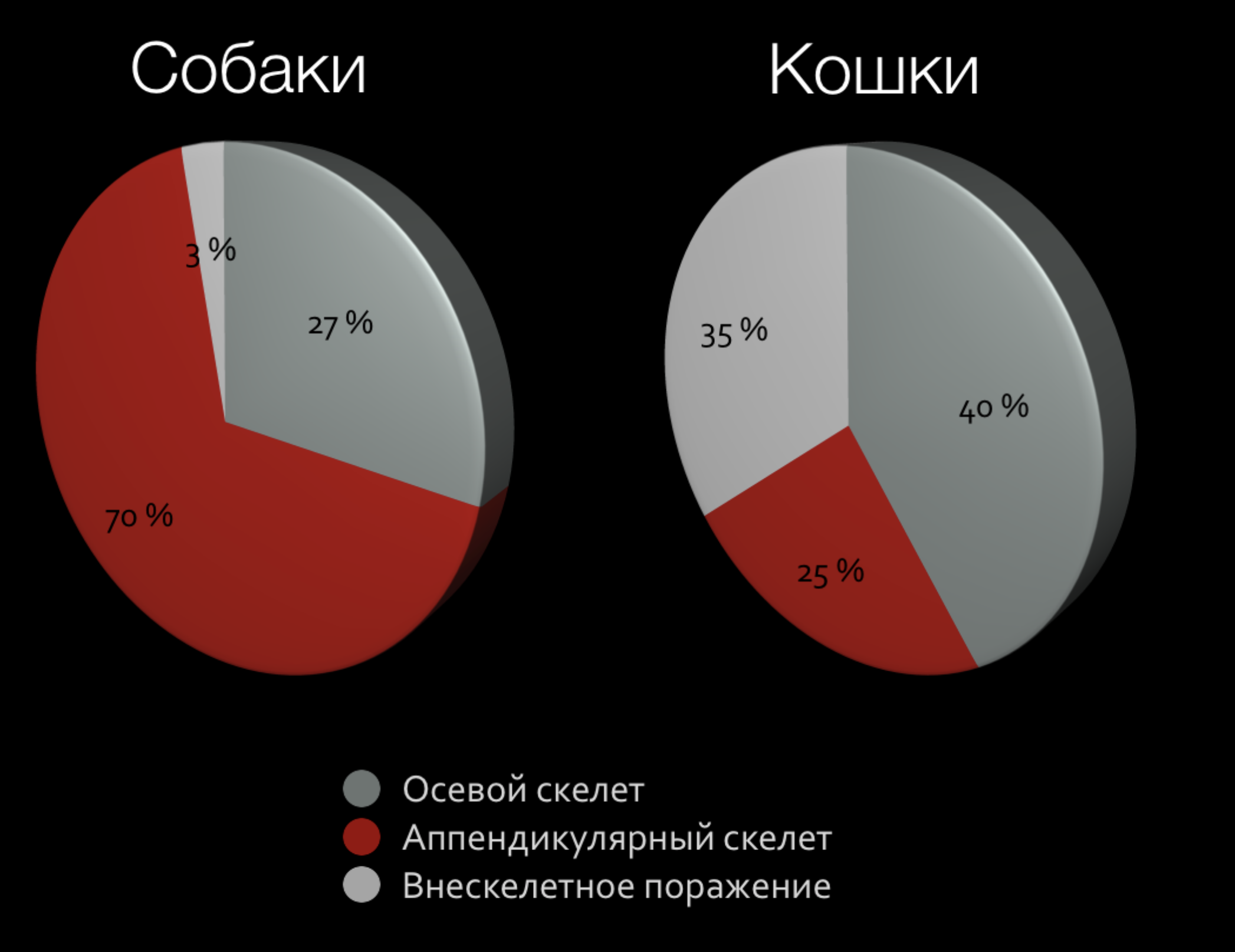
Новообразования (НО) опорно-двигательного аппарата у собак диагностируются у 4% онкологических пациентов, при этом остеосаркома встречается более чем в 90% случаев всех спонтанных опухолей кости и является наиболее распространенной первичной опухолью кости у собак [1, 2, 3]. Выделяют 2 основные формы остеосаркомы (ОС):
1) аппендикулярная ОС (70-75%), поражает в 70% длинные трубчатые кости (аппендикулярный скелет), чаще метафизарную область;
2) аксиальная или осевая форма ОС (28%), которая поражает осевой скелет (череп, позвоночный столб, грудину, ребра, кости таза) [4, 5, 6] (рис. 1).
Первичные поражения, как правило, моноосальные и для ОС не характерно вовлечение сустава. До 40% случаев поражения приходится на дистальный сегмент лучевой кости [2, 4]. ОС аппендикулярного скелета чаще поражает крупных собак, характеризуется быстрым, тяжелым течением и ранним гематогенным метастазированием в легкие [1, 7]. Возрастные собаки поражаются гораздо чаще, чем молодые. Средний возраст собак около 7-10,5 лет [8, 3, 9]. Около 90% всех ОС встречаются у собак с массой тела больше 20 кг. Отмечено два возрастных пика инцидентности ОС. Это возраст 18-24 месяцев и старше 10 лет [4]. Встречаемость поражения же ОС у мелких пород собак в 20 раз меньше по сравнению с крупными [4].
Наиболее частая локализация поражения ОС аппендикулярного скелета представлена на (рис. 2):
1. дистальная часть лучевой/локтевой кости (наиболее часто) 40% (Cooley&Waters, 1997);
2. проксимальный отдел плечевой кости (часто);
3. дистальная часть бедренной кости (проксимальная редко; Brodey&Riser, 1969);
4. проксимальная/дистальная часть большеберцовый кости.
Факторы риска развития ОС и породная предрасположенность
В большинстве случаев ОС развивается спонтанно. Однако, по литературным данным, отмечена связь с предшествующей лучевой терапией в результате переломов (размещения металлических имплантатов и/или как следствие костных инфарктов (Withrow&Vail, 2007). Также есть данные по корреляции уровня половых гормонов с повышенным риском развития ОС у ротвейлеров. Считается, что ранняя ОГЭ может привести к повышенному риску развития ОС у данной породы собак [10]. Отмечена предрасположенность определенных пород к ОС: ротвейлер, сенбернар, дог, грейхаунд, борзые, ирландский сеттер, доберман пинчер, золотистый ретривер, ирландский волкодав, борзая, шотландская борзая, немецкая овчарка [8, 9, 11, 12,].
Метастатическое поражение при ОС
У собак с аппендикулярной остеосаркомой на первичном приеме метастазы (МТ) в легких возможно обнаружить в 11-18% случаев (Brodey, 2004). На момент постановки диагноза около 8% пациентов могут иметь вторичные метастазы в кости (Dernell et al., 2007). Считается, что около 90% пациентов уже имеют микрометастазы на момент первичного обращения (N. Bacon, 2014). В связи с этим ранняя химиотерапия имеет ключевое значение для увеличения продолжительности жизни пациента в случае комбинированного (хирургического) лечения. Путь метастазирования при ОС гематогенный, с поражением легких или контралатеральных костей конечностей. В 25% отмечаются МТ в регионарные лимфатические узлы (Britt et al., 2007).
Клиническая картина при ОС
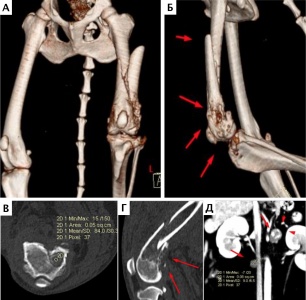
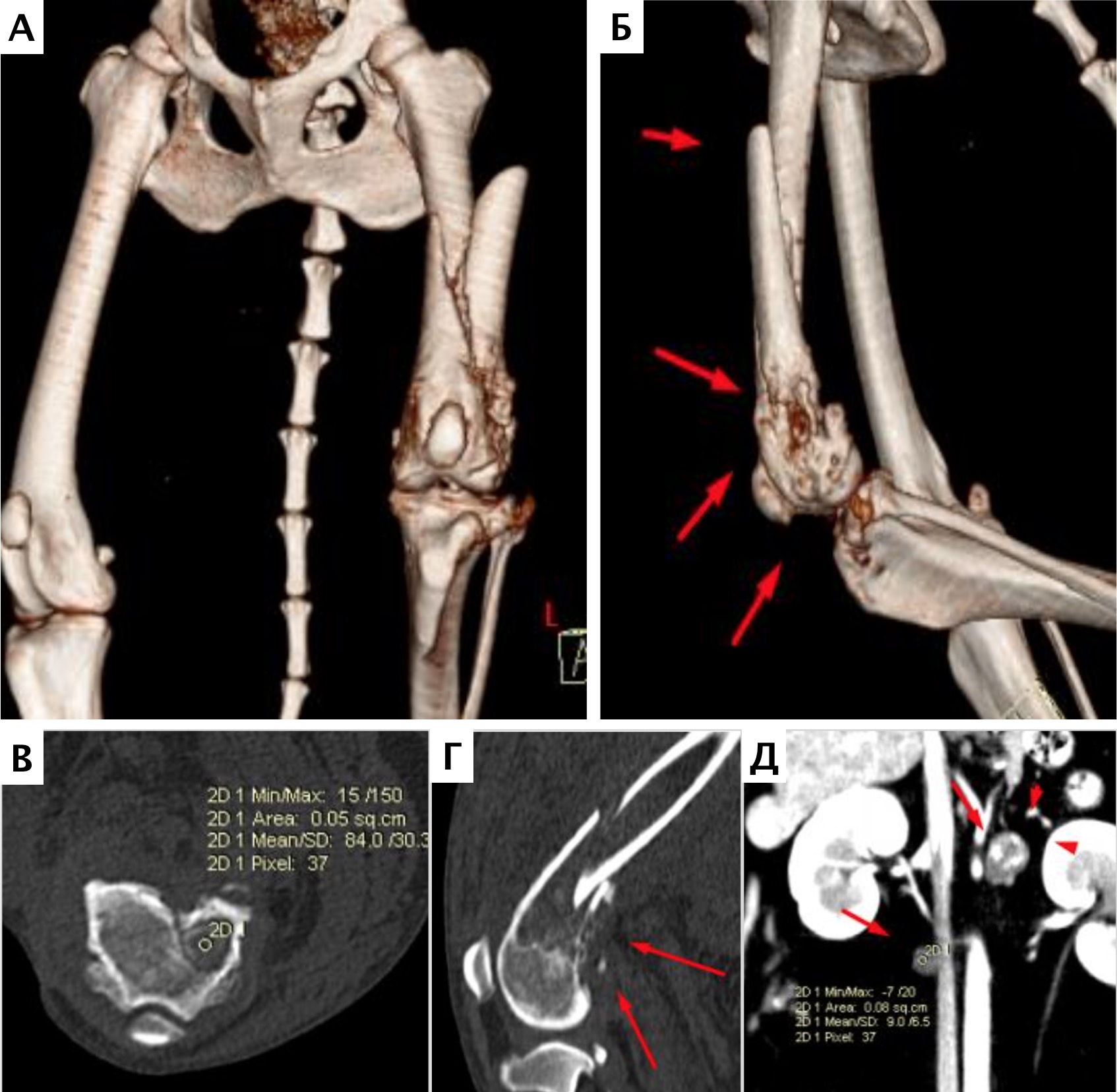
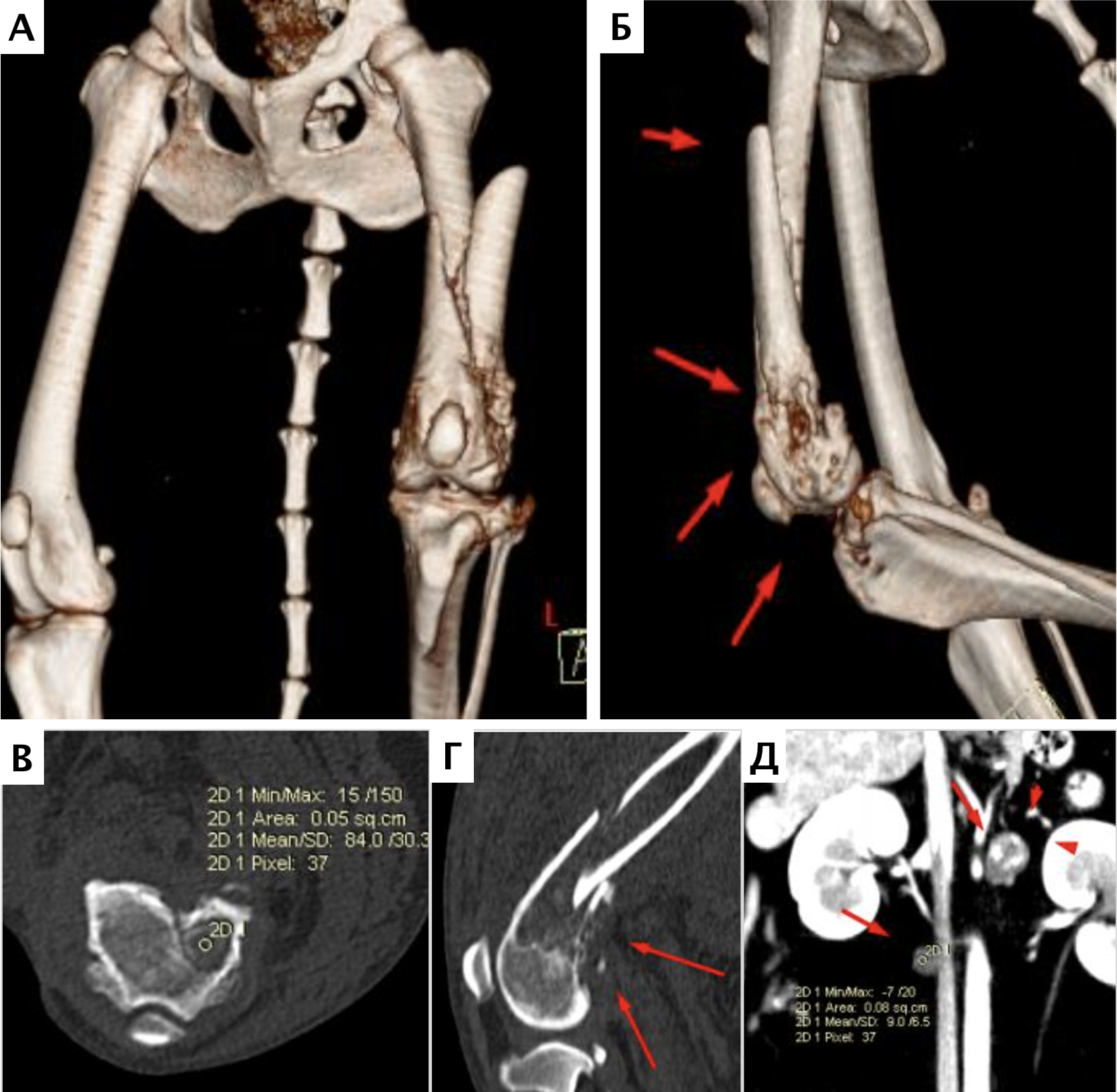
При ОС пациентов беспокоит болевой синдром и, как следствие, хромота различной степени выраженности, перемежающаяся по типу опирающейся конечности, медленно прогрессирующая (на ранней стадии); по типу висячей конечности на поздней стадии или в случае патологического перелома. Степень хромоты не зависит от нагрузки и не коррелирует с рентгенологическими изменениями при ОС (Boulay et al., 1997). Выраженный болевой синдром возникает, как правило, в результате эффекта «распирания» НО с последующим формированием микротрещин, разрушением кости (остеолизис) и реакцией надкостницы. Нередко можно выявить отек или утолщение пораженной части конечности, что бывает более очевидно при ОС дистальной части предплечья или голени за счет увеличения мягкотканного или костного компонента. Патологический перелом (ПП) встречается примерно в 3% случаев, однако иногда может быть «первым симптомом» без истории длительной хромоты [4, 6] (рис. 3). При возникновении ПП всегда появляется хромота по типу висячей конечности. Основной механизм развития ПП – это остеолизиз.
А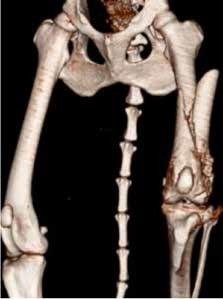 Б
Б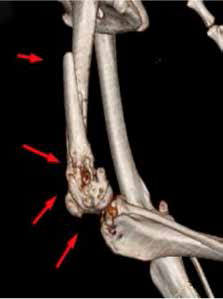 В
В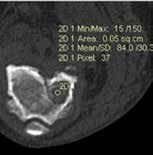 Г
Г 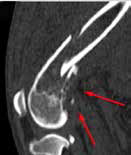 Д
Д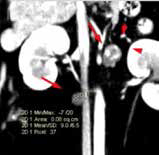
Рис. 3. А-Г – Патологический перелом дистального сегмента бедренной кости у собаки на фоне остеосаркомы. При онкопоиске выявлено: поражение парааортальных,
паховых лимфатических узлов, очаговое поражение на уровне каудальной полой вены (Д), очаговое поражение правого надпочечника (Д). Гистологический диагноз: остеосаркома
Клинический подход к пациенту с ОС. Ключевые положения:
1. Ортопедическое обследование: боль, отек, хромота, пальпация регионарных л/у;
2. Инструментальная диагностика:
a. рентген пораженной конечности + контралатеральной грудной и тазовых конечностей + грудной клетки (3 проекции на левом на правом боку, вентро-дорсальная проекция). Метастазы более ≥4-6 мм, как правило, визуализируются при цифровой рентгенографии.
3. КТ: онкопоиск, исключение МТ. Также оценка периостальной реакции и распространения ОС в интрамедуллярном канале при планировании объема резекции в случае ОСО; опция)
4. МРТ: определение области резекции; распространения ОС в интрамедуллярном канале. Более чувствительно, чем КТ.
5. Лабораторная диагностика:
a. клинический и биохимические анализы крови;
b. оценка щелочной фосфатазы (ЩФ) как прогностического фактора;
6. биопсия (в сомнительных случаях и при нетипичной локализации ОС);
7. гистологическое исследование (стандарт; всегда необходимо для окончательной диагностики).
Визуальная диагностика первичных НО кости. Онкологический поиск
Диагностика НО костей во всех случаях комплексная. Знание истинного распространения ОС необходимо как для оценки эффективности проводимой химиотерапии, так и для выбора оптимального вида оперативного вмешательства. Диагноз ставят на основании клинических признаков результатов рентгенологического, цитологического и гистологического исследований. Стоит отметить, что на сегодняшний день ставят под сомнение ценность гистологической классификации остеосаркомы для прогнозирования результатов лечения аппендикулярной ОС у собак ввиду слабой корреляции по ряду данных [13].
Предварительный диагноз ОС нередко может быть сформулирован на основании: клинической картины, анамнеза, физикального осмотра и рентгенологического исследования. В диагностике ОС рентгенологический метод исследования позволяет обнаружить НО кости, выявить периостальную реакцию, а также протяженность распространения поражения в пределах кости и в мягких тканях, однако менее точно, чем МРТ и КТ [14]. Для исключения метастатического поражения (МТ), могут быть использованы такие методы расширенной визуальной диагностики как компьютерная томография (КТ), магнитно-резонансная томография (МРТ) (оценка объема резекции), сцинтиграфия, позитронная эмиссионная томография (ПЭТ или ПЭТ/КТ).
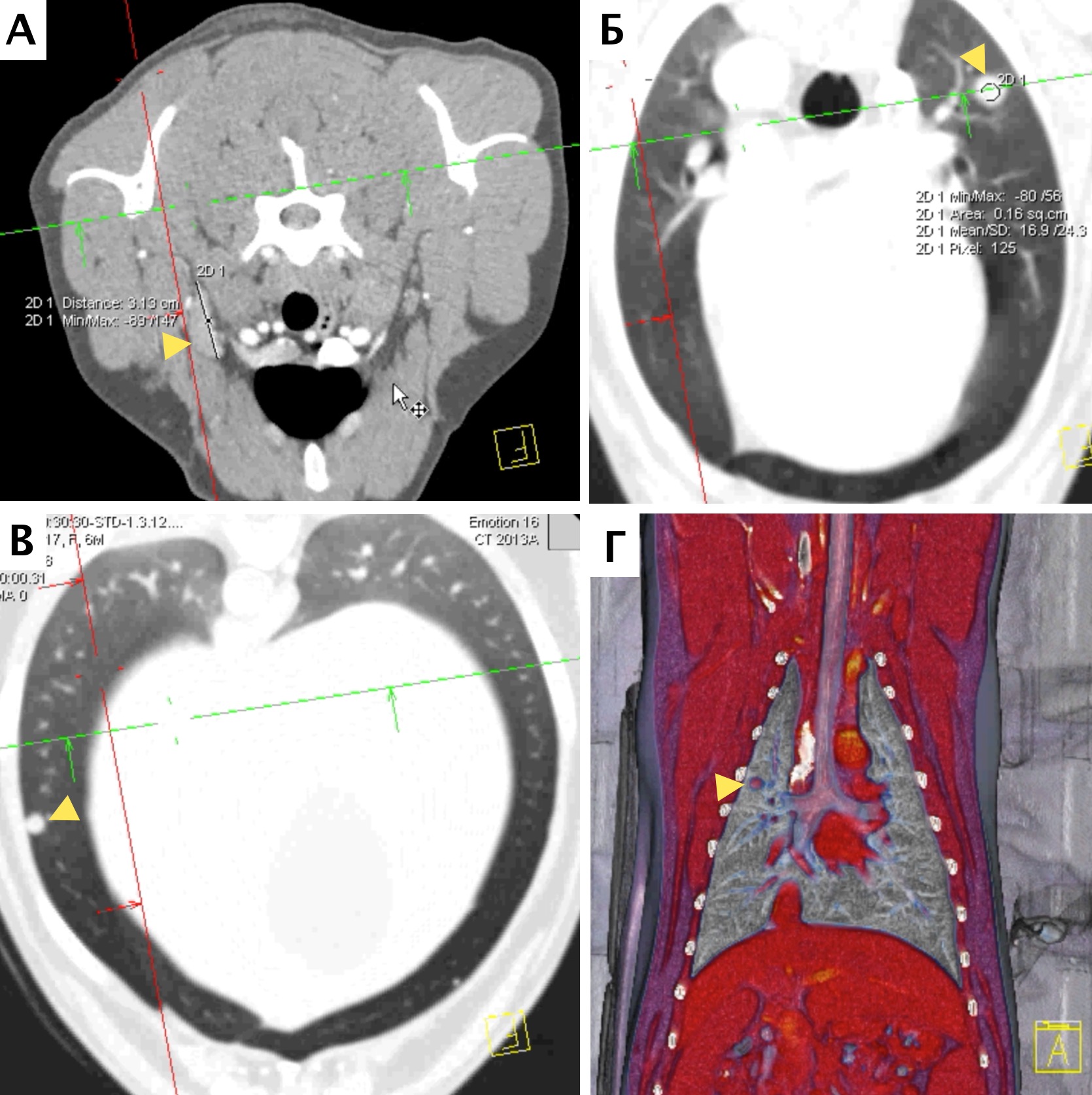
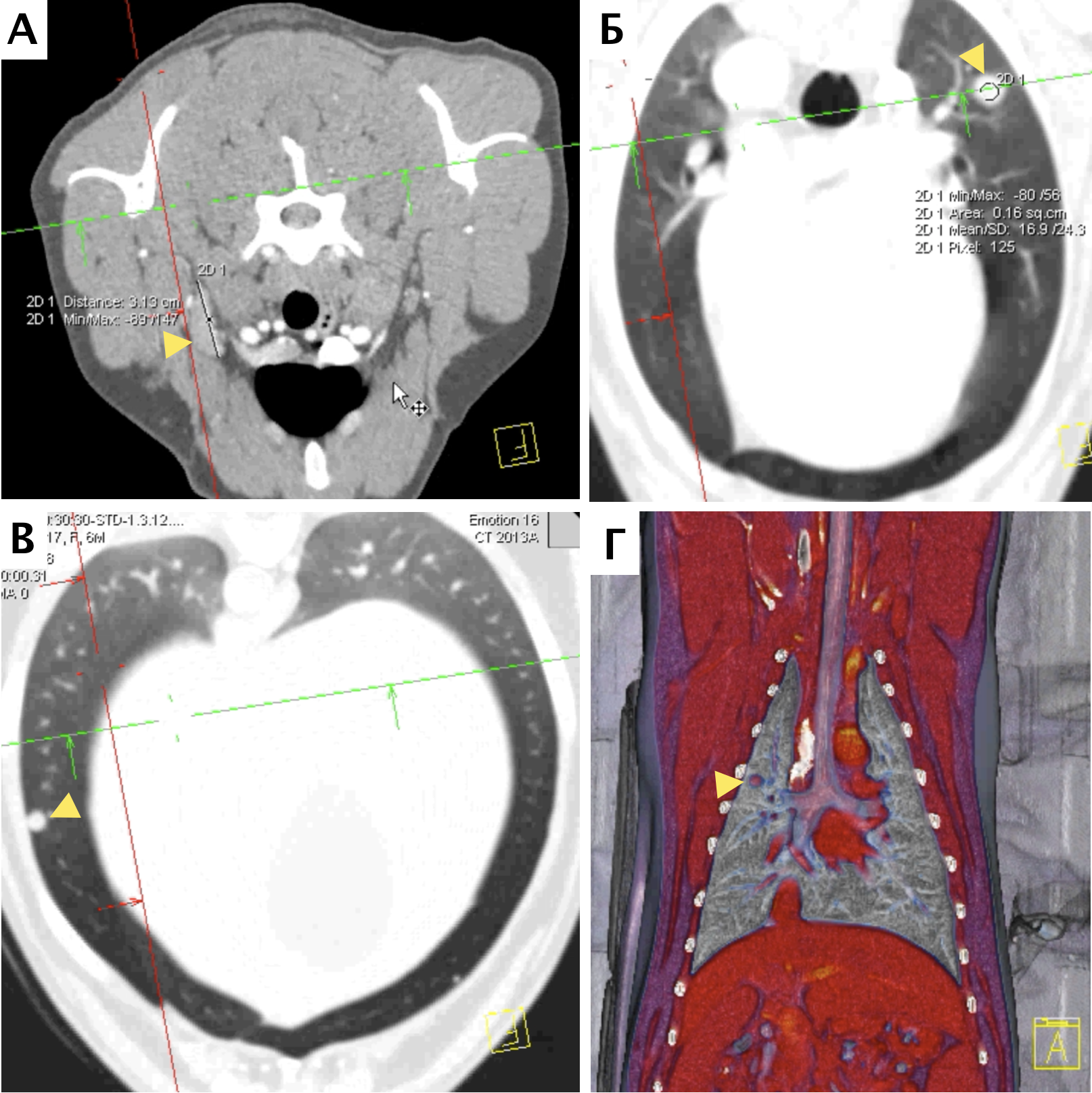
В настоящее время в гуманной и ветеринарной медицине рекомендовано выполнять КТ для выполнения онкопоиска «скрытых» метастазов в органах грудной и брюшной полости и малого таза с целью исключения метастатического поражения [6, 4]. С помощью КТ возможно выявить метастатические поражения в легочной ткани размером до 1 мм (Waters et al., 1998; Nemanic et al., 2006) (рис. 4). У КТ имеются значительные преимущества перед стандартной рентгенографией, такие как: более точная оценка степени и глубины поражения костной ткани; выявление минимальных и начальных изменений кости (периостальная реакция). Распространение мягкотканого компонента опухоли по данным КТ с контрастом определяется также более точно, чем на рентгенограммах за счет изменения коэффициента поглощения рентгеновских лучей опухолью [14]. КТ является более чувствительным методом для оценки границ инвазии НО. ИМ распространения остеосаркомы в сравнении со стандартной рентгенографией, однако менее чувствительной в сравнении с МРТ [6, 11]. МРТ пораженной конечности является более точным и специфичным исследованием, чем КТ для локальной оценки НО кости (Sugiura et al., 2002). Информативность МРТ повышается благодаря отсутствию артефактов, которые имеют место при КТ-исследовании, также МРТ дает хорошую дифференцировку мягких тканей, позволяя различать нормальную, гиперваскуляризированную и опухолевую ткани. МРТ является более чувствительным методом для оценки инвазии НО, поражения мягкотканного компонента и ИМ распространения ОС, что является крайне важным для определения объема резекции НО при планирования ОСО [15, 9].
А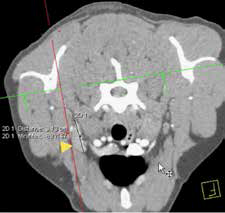 Б
Б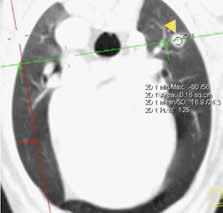 В
В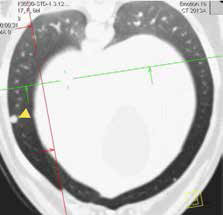 Г
Г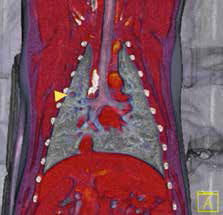
Рис. 4. КТ пациента с ОС в режиме онкопоиск. Выявлены метастатические поражения подмышечного лимфатического узла (А), легких (Б-Г) (узлы: 2 мм и 4 мм.).
По денситометической оценке (Б), поражения характерны для мягкотканного компонента, что часто наблюдается при метастатическом поражении
В случае планирования ОСО с последующим замещением костного дефекта индивидуальными имплантатами и для разработки персонифицированных (индивидуальных) направителей, изготавливаемых методом 3D-печати, необходимо выполнение КТ-конечностей.
Диференциальная диагностика остеосаркомы включает: различные другие опухоли кости (фибросаркома, хондросаркома), инфекции (грибковые или бактериальные остеомиелиты), костные кисты (редко), метастатические поражения (опухоли почек, ОМЖ, предстательной железы) [16].
Биопсия
Биопсия необходима для морфологического подтверждения диагноза и может требоваться при нетипичной локализации предполагаемой первичной опухоли кости, а также для дифференциации от других патологий с характерными рентгенографическими изменениями. Стоит отметить, что выполнение биопсии рекомендовано проводить оперирующему в последующем хирургу, так как при планировании ОСХ следует вовлекать в зону резекции области, где была выполнена биопсия [6]. Для сведения: к минимуму потенциальной диссеминации опухоли ряд авторов рекомендует предпринять попытку выполнения трепанобиопсии иглой типа Jamshidi [2, 4]. Выполнение биопсии несоответствующими методами приводит к осложнениям в ране (диссеминация опухолевых клеток, инфицирование) у 20% пациентов, и в 10% случаев неправильно спланированная и выполненная биопсия приводит к невозможности выполнить ОСХ операцию в первичном очаге, по данным гуманной медицины [17].
Стратегия лечения при аппендикулярных ОС
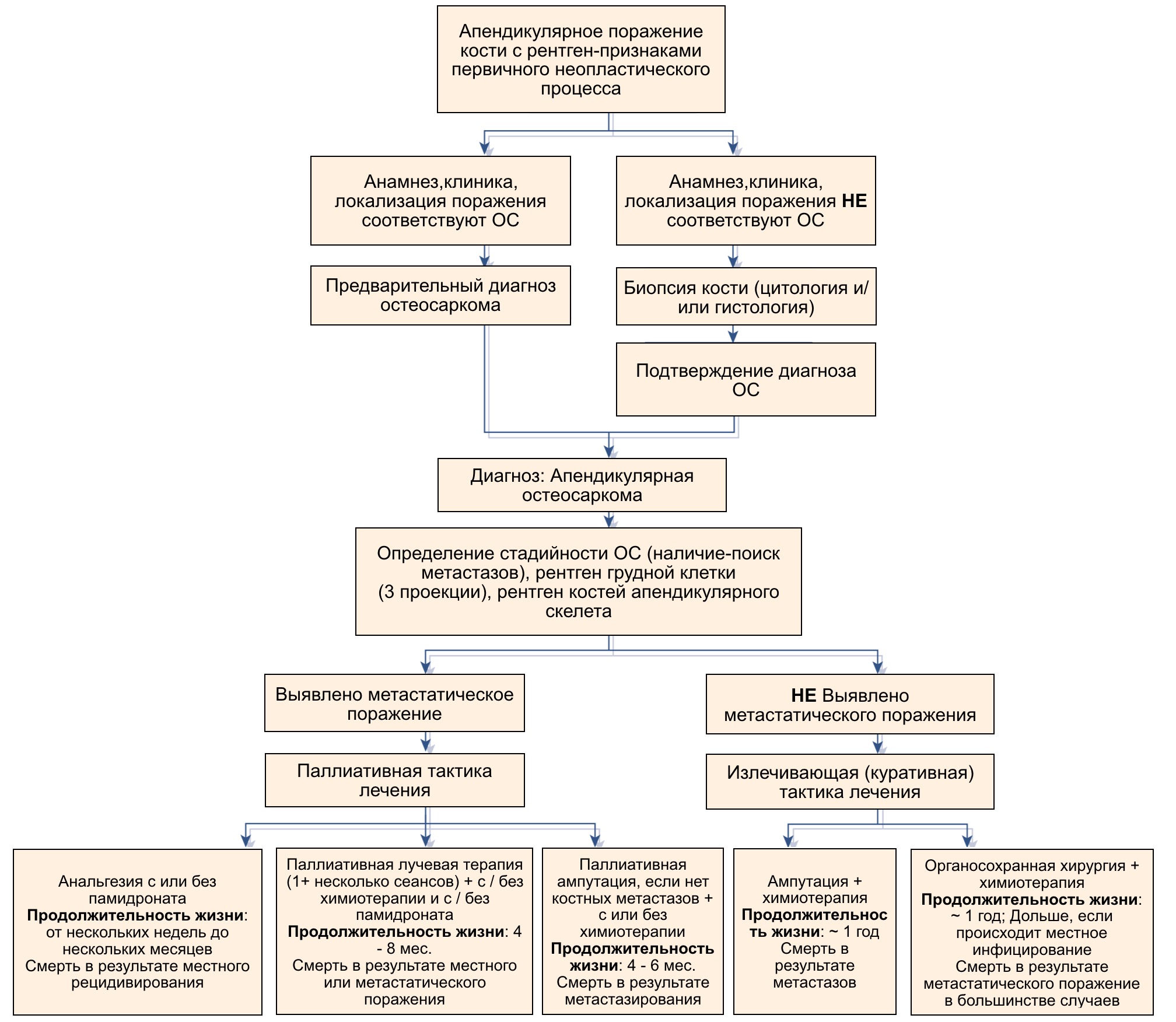
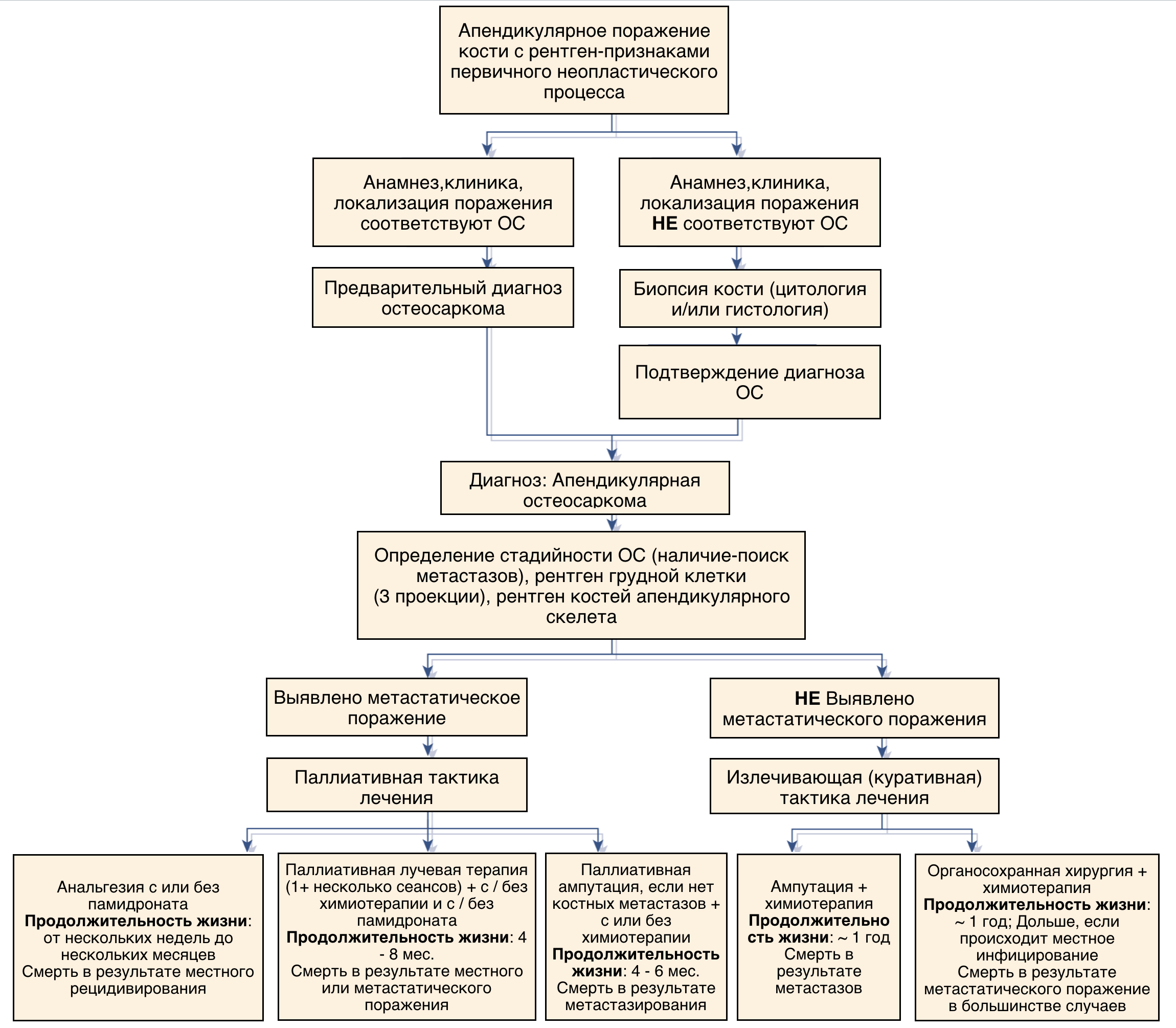
На сегодняшний день лечение остеогенной саркомы представляет собой мультимодальный подход. Стандартом лечения аппендикулярной ОС у собак является хирургическое лечение в сочетании с химиотерапией [9, 6]. Во всех случаях требуется выполнять удаление первичного очага опухоли с минимальным функциональным ущербом, но с соблюдением принципов онкологического радикализма и с обязательным применением химиотерапии в пред- и послеоперационный период. Для удобства принятия решения можно использовать алгоритм ведения пациентов с НО аппендикулярного скелета (рис. 5).
Варианты лечения при первичной НО кости:
· консервативное (паллиативное) лечение (обезболивание с применением НПВС, габапентин, трамадол). Средняя длительность жизни не более 3-х месяцев [11] (Bacon N., 2015);
· лучевая терапия +/-химиотерапия (обезболивание);
· хирургическое лечение.
o Радикальные методы:
- полная ампутация (без химиотерапии);
- полная ампутация + химиотерапия.
o Органосохранные (органосберегающие) операции (ОСО):
- широкая сегментарная резекция с одномоментной реконструкцией (или без) костного дефекта эндопротезом, ауто/аллотрансплантатом + химиотерапия;
- экстирпация всей пораженной опухолью кости с замещением дефекта аллотрансплантатом (эндопротезом) или без замещения + химиотерапия;
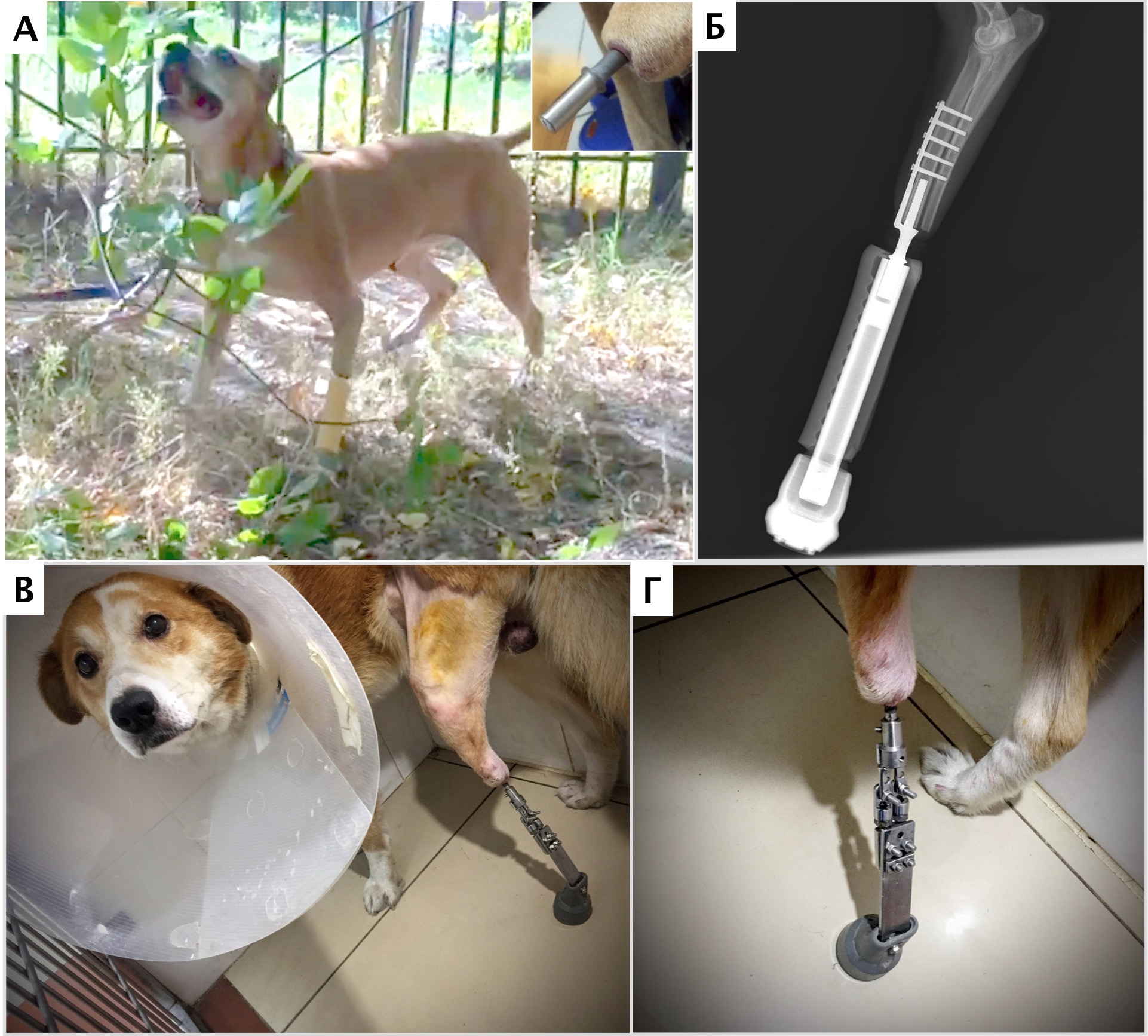
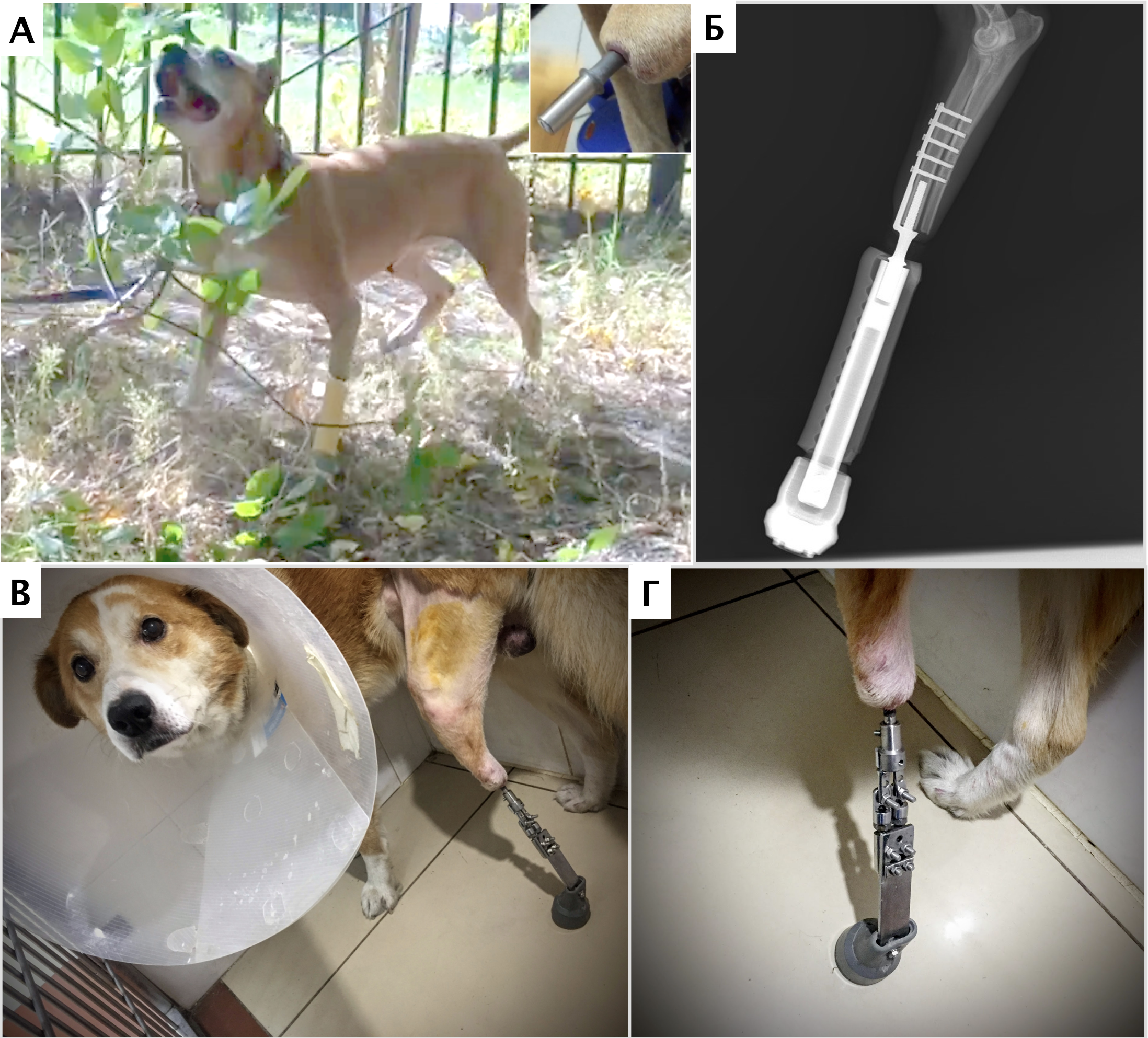
- остеоинтегрируемое протезирование + химиотерапия. Методика может быть использована при «низких» ампутациях при НО кости, мягких тканях пальцевых фаланг, запястья/пясти, заплюсны/плюсны; (подколенные, подлоктевые; опция, требуется тщательный подбор кандидатов) (рис. 6).
А  Б
Б  В
В 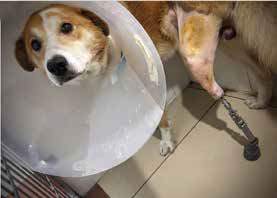 Г
Г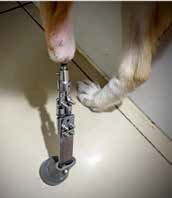
Рис. 6. А, Б – Примеры чрескожного остеоинтегрируемого протезирования (ЧОП) грудной и тазовой конечностей протезами SerGoFIX у собак после ампутации на уровне диафизарного
сегмента предплечья по поводу синовиальной саркомы запястья (А,Б) и после подколенной посттравматической ампутации (В, Г). В, Г – было выполнено 2-х этапное протезирование:
ампутация с последующей имплантацией остеоинтегрируемого (ОИ) протеза
Консервативное лечение в монорежиме в случе отказа от хирургического лечения включает в себя покой и применение анальгетиков. Также в комбинированной терапии может быть рекомендовано: НПВС (карпрофен, фирококсиб, мелоксикам); трамадол; габапентин (10-20 мг/кг, 3 раза в день).
Бисфосфонаты (БФН)
В комплексном лечение ОС могут быть применены ингибиторы остеокластов (резорбции). Показанием являются: первичные и метастатические поражения костей. Известно, что БФН могут замедлять остеолизис кости, профилактируя развитие патологического перелома, а также снижать болевой синдром при метастатических поражения [4,9].
Бисфосфонаты (памидроновая/золедроновая кислота): 1 мг/кг, в/в, медленно, раз в 4 недели).
Химиотерапия. Статистика
Статистически было доказано, что применение химиотерапии позволяет значительно продлить жизнь животным после операции при аппендикулярной ОС (Berg 1996; Moore et al., 2007; Phillips et al., 2009; Skorupski et al., 2013). Наиболее часто используемые препараты: карбоплатин, цисплатин в монорежиме или в комбинации с доксорубицином (Berg et al., 1992, 1997, Bergman et al., 1996, Chun et al., 2005). В связи с высоким метастатическим потенциалом, адъювантная химиотерапия (карбоплатин) рекомендуется во всех случаях (Kirpensteijn et al., 1994). После химиотерапии органосохранная операция может быть выполнена или через 2 дня, или через 14 дней. Отмечено, что при выполнении ОСХ через 14 дней количество системных осложнений может быть меньше [11]. По другим данным не было значимых различий во времени выживания, при начале химиотерапии до операции, интраоперационно или через 3 недели после операции [18]. Стоит отметить, что независимо от используемого протокола, средняя продолжительность жизни пациентов 300-365 дней. Двухлетняя выживаемость отмечается в 20-25% случаев [9,4].
Наиболее широко используется протокол: монорежим карбоплатина (300 мг/м2, 1 раз в 3 недели, 3-4 курса). Средняя продолжительность жизни – 321 день (Bergman et al., 1996). Доксорубицин в качестве монотерапии (вспомогательной к ампутации) каждые 2 недели в течение пяти циклов приводит к среднему времени выживания около 8 месяцев и 2-х лет – в 17% у 303 собак (Moore et al., 2007). Протокол «ампутация – адъювантная химиотерапия» или же органосохранная операция у собак с ОС плюс адъювантная химиотерапия дает примерно одинаковое в среднем время выживания в течение 321 дня (Bergman et al.,1996).
Мурамилдипептид
Обнадеживающие результаты были получены при исследовании комбинированного лечения препаратом мифамуртид (мурамил трипептид фосфатидилэтаноламином (L-MTP-PE), синтетическим аналогом мурамилдипептида (МДП) [19]. Мифамуртид применяется для лечения низкодифференцированной неметастатической операбельной остеосаркомы после макроскопически полной хирургической резекции у детей, подростков и взрослых. Препарат применяется в комбинации с послеоперационной многокомпонентной химиотерапией. Действующее вещество является самым маленьким существующим в природе иммуностимулирующим компонентом клеточной стенки Mycobacterium spp. Он обладает такими же иммуностимулирующими свойствами, как природный МДП с дополнительным преимуществом более длительного T1/2 из плазмы. По результатам двух рандомизированных двойных слепых клинических исследований у собак со спонтанной аппендикулярной ОС, получавших комбинированную химиоиммунотерапию, было выявлено что L-MTP-PE обладает антиметастатической активностью у собак с остеосаркомой при назначении после ампутации [20].
Препарат применяют в сочетании с послеоперационной мультимодальной химиотерапией, что улучшает показатели общей выживаемости пациентов в гуманной медицине. В клиническом испытании фазы III у людей около 800 вновь диагностированных пациентов с остеосаркомой сочетали мифамуртид с химиотерапевтическими средствами доксорубицином и метотрексатом с применением цисплатина и ифосфамида, или без него. Отмечено увеличение общей выживаемости и безрецидивный период. Смертность может быть снижена на 30% по сравнению с химиотерапией плюс плацебо. Через 6 лет после лечения 78% пациентов были еще живы. Это соответствует абсолютному снижению риска на уровне 8% (р=0,03) (Meyers et al., 2005; Meyers et al., 2008).
Стратегия хирургического лечения при аппендикулярной ОС
В современной гуманной онкоортопедии развитие химиотерапии, внедрение новых подходов в хирургической технике и проведение анестезиологического пособия, развитие технологии изготовления эндопротезов, позволило кардинально изменить качество жизни у людей и улучшить выживаемость пациентов, а также максимально возможно продлить срок службы самих имплантатов (прим.: в онкоортопедии используют понятие «выживаемость эндопротезов/имплантатов»). Вследствие чего сегодня органосохранные операции являются золотым стандартом лечения пациентов с диагнозом НО кости в гуманной медицине [21, 22].
Тотальная (полная) ампутация конечности с адъювантной химиотерапией часто является стандартом лечения при НО аппендикулярного скелета у собак, и все реже у людей (Marks L.J., Michael J.W.;BMJ. 2001) [4, 9]. В последнее время в ветеринарной медицине все чаще отдается предпочтение органосохранным операциям (ОСО) [4, 23 11].
Тщательное предоперационное планирование хирургического вмешательства и отбор пациентов является важнейшим условием успешного удаления первичной НО кости.
Выделяют следующие виды оперативного лечения при первичных костных НО:
1. радикальные (калечащие) операции (ампутации, экзартикуляции);
2. органосохранные операции (не требующие последующей реконструкции дефекта; требующие последующей реконструкции дефекта).
Ключевыми аспектами при ОСО пациентов с диагнозом «саркома кости» является радикальность и абластичность удаления опухоли, что позволяет не допустить местного рецидива [21].
Хирургическое лечение только в объеме ампутации конечности (без химиотерапии) у собак не дает удовлетворительных результатов, так как не позволяет значимо увеличить длительность жизни пациента. Метастазы появляются в те же сроки, что и без лечения [4,6,1].
Относительные противопоказания к ампутации конечностей у животных могут включать: дегенеративные поражения контралатеральных конечностей (тяжелый остеоартрит); избыточная масса тела (ожирение); сопутствующие неврологические патологии (синдром Кауда Эквина «дегенеративный пояснично-крестцовый стеноз») [6, 2]. Несмотря на более чем удовлетворительные результаты после перенесенной тотальной ампутации грудной конечности, у некоторых крупных собак в сравнении с карликовыми, отмечается: сложность в поддержке равновесия, крупные собаки значительно чаще падают в сравнении с мелкими и карликовыми породами собак (Budsberg SC; 1995). Собаки после ампутации грудной конечности хуже и более длительно восстанавливаются в сравнении с собаками после ампутации тазовой конечности. Также отмечается существенное изменение походки у таких животных [23, 5].
Органосохранные операции (ОСО)
Хирургическое лечение до настоящего времени остается одним из необходимых этапов при комбинированном лечении остеосаркомы. Как было отмечено выше, в абсолютном большинстве случаев при ОС требуется предоперационная (неоадъювантная) и послеоперационная (адъювантная) химиотерпия для достижения лучшего результата [9].
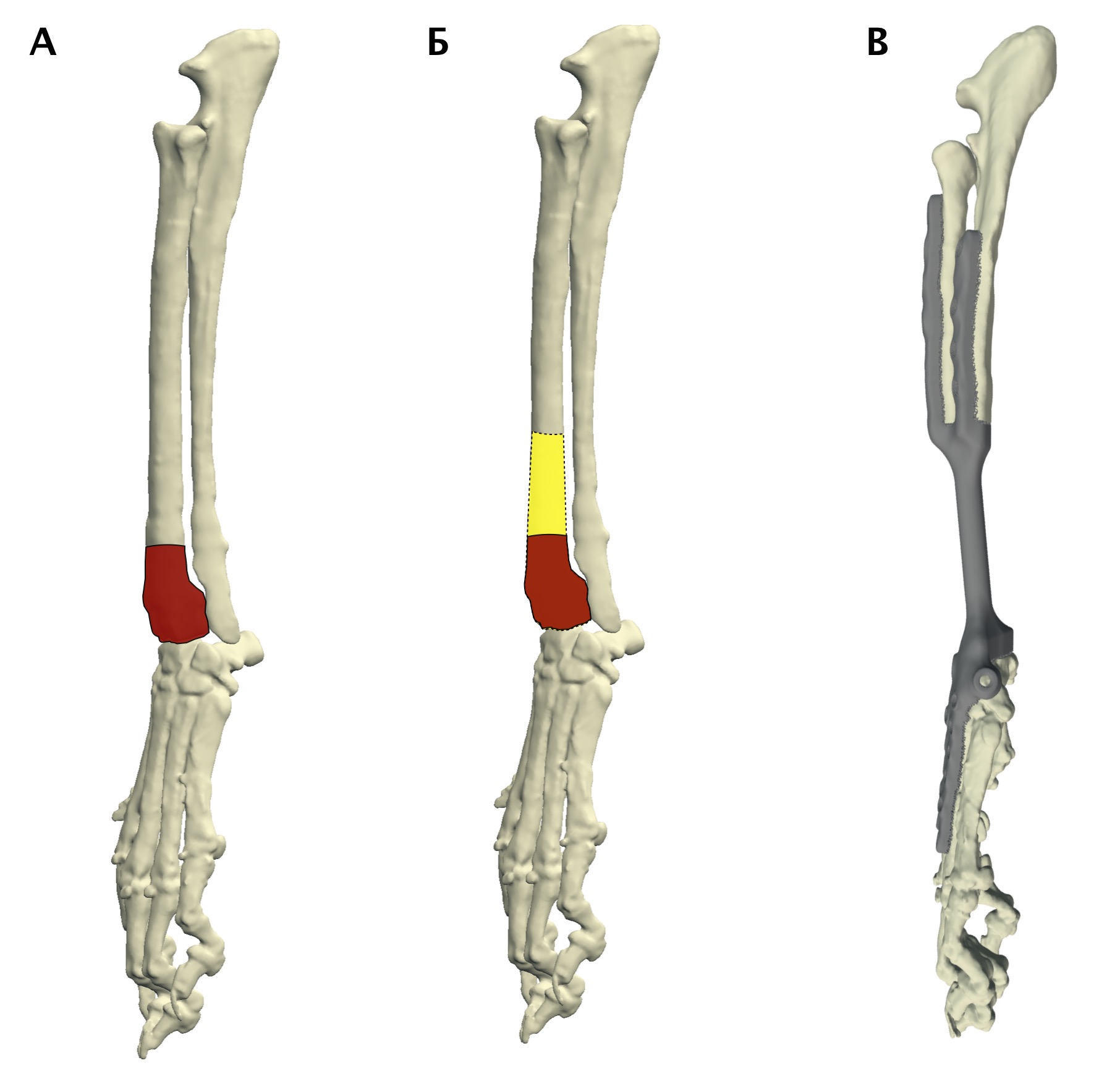
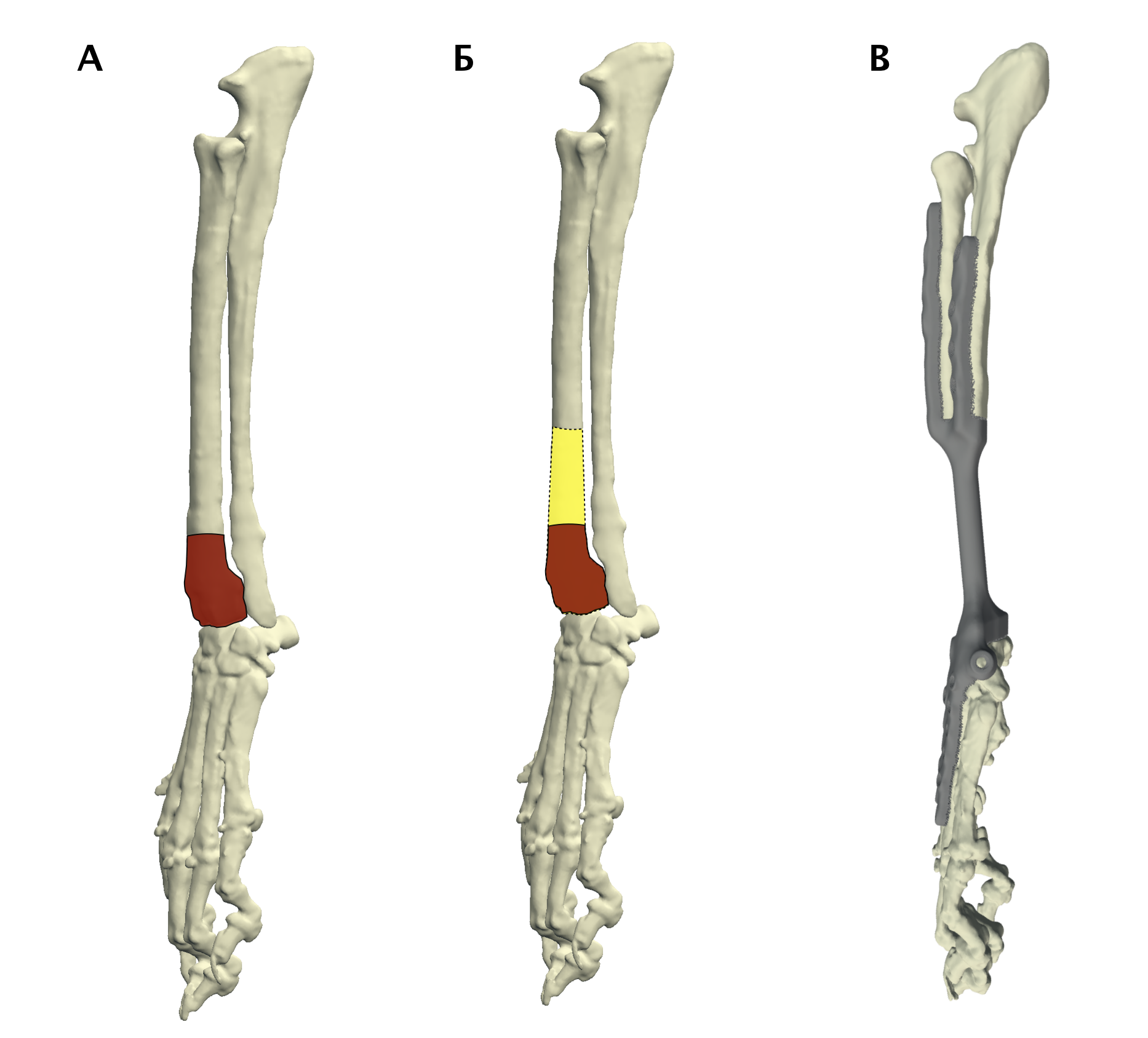
Основная концепция ОСО заключается в широкой резекции пораженного сегмента кости в мышечно-фасциальном футляре в пределах здоровых тканей с последующим одномоментным замещением костного дефекта ауто-/аллопластикой или эндопротезированием [9, 23] (рис. 7).
А 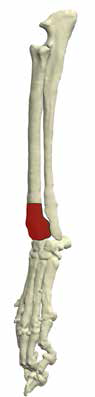 Б
Б 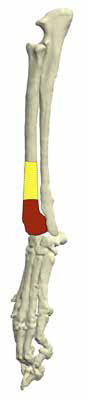 В
В 
Рис. 7. Методология органосохранной операции при аппендикулярной ОС (схематично). А – пораженный сегмент кости остеосаркомой
(область выделена касным). Б – уровень широкой сегментарной резекции кости (желтый участок «здоровой» кости удаляется
вместе с очагом ОС с отступом 4-5 см от границы видимого костного остеодеструктивного поражения. В – замещение
пострезекционного костного дефекта эндопротезом (индивидуальным, титановым; также может быть
использован армированный костноцементный протез)
Основные принципы оперативного вмешательства при злокачественных опухолях костей были сформулированы еще в 1980 г. Enneking W.F. и применяются в настоящее время [24]:
· абластичность – комплекс приемов, препятствующих рассеиванию опухолевых клеток в процессе операции (достигается, прежде всего, исключением грубых манипуляций с опухолью);
· зональность – предполагает удаление опухоли вместе с окружающими ее здоровыми тканями, по ходу лимфатического оттока;
· удаление en Block – предполагает удаление опухоли в пределах выбранных хирургических границ единым блоком, без кускования;
· футлярность – предполагает удаление опухоли вместе со всем содержимым фасциального футляра, который она инфильтрирует.
Органосохраняющая операция стандартно включает три основных этапа:
1) широкая резекция пораженной кости в мышечно-фасциальном футляре без вскрытия псевдокапсулы единым блоком (en Block) вместе с окружающими мягкими тканями;
2) замещение пострезекционного костного дефекта (эндопротезирование);
3) закрытие мягкими тканями послеоперационного дефекта.
При невозможности выполнения органосохраняющего лечения в связи с местной распространенностью опухоли, в случае отсутствия ответа на лечение и отсутствием клинического эффекта после проведения неоадъювантного лечения проводится ампутация конечности.
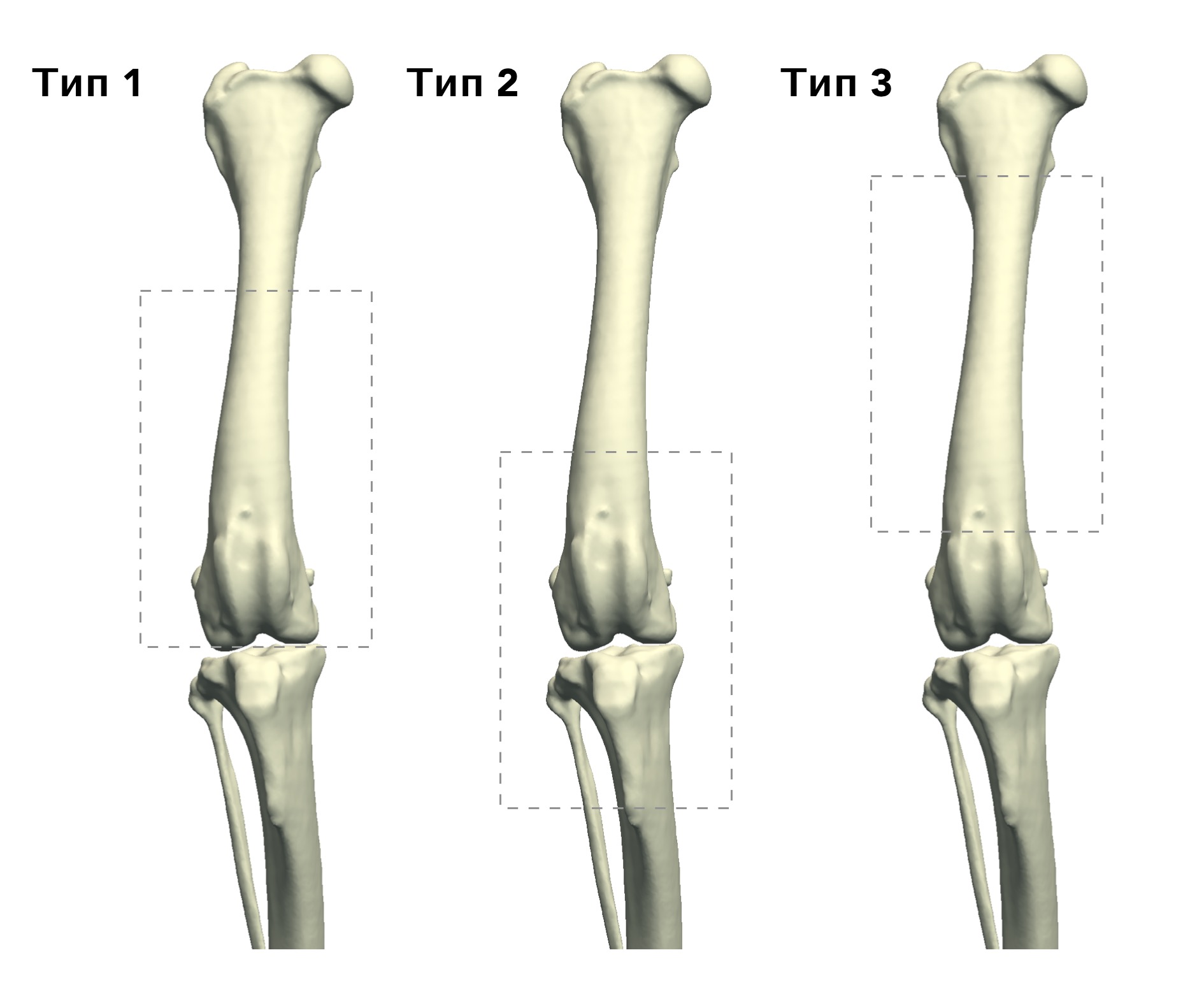
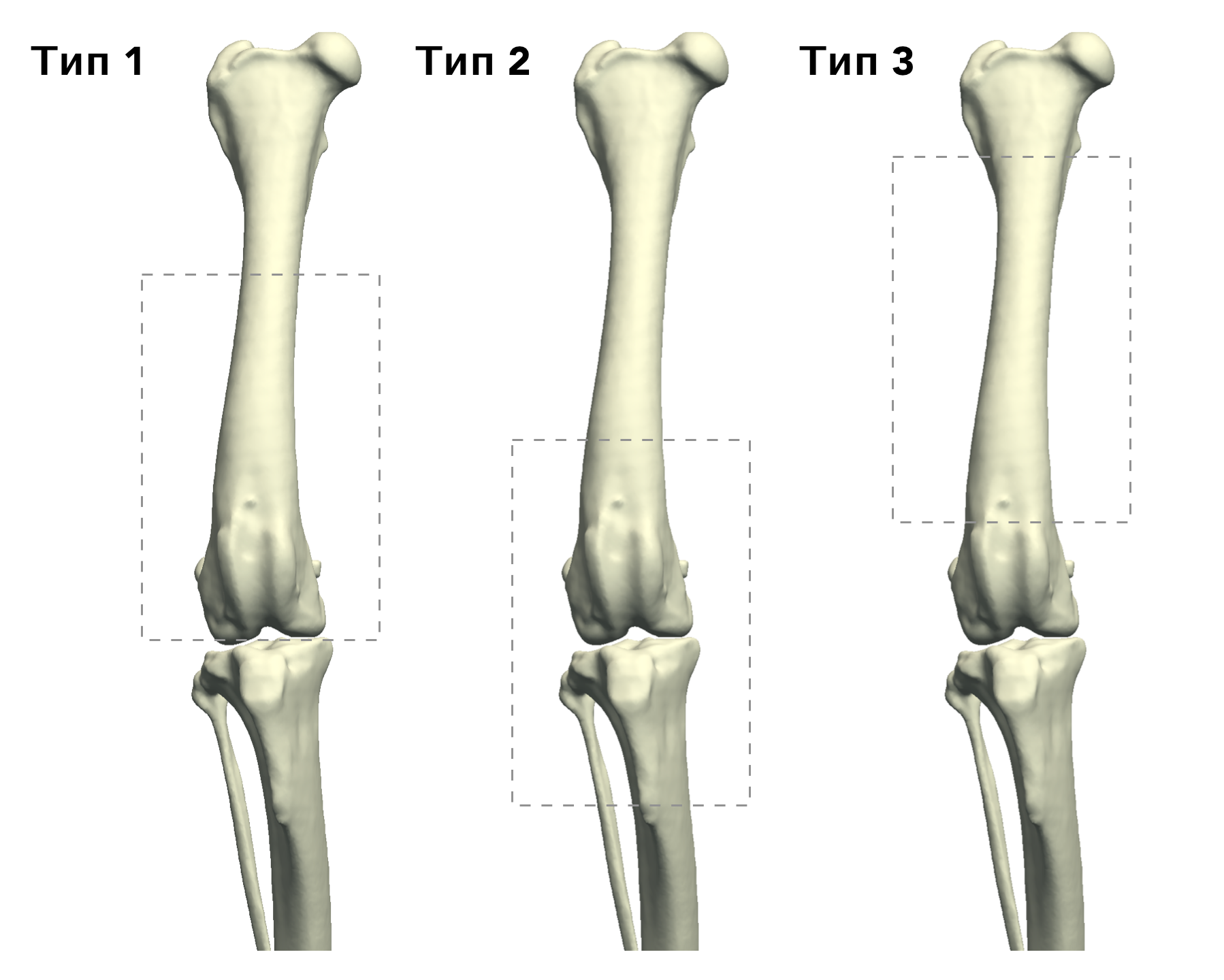
В гуманной онкоортопедии различают 3 типа резекции НО при органосохраняющих операциях по Enneking [25] (рис. 8):
Тип 1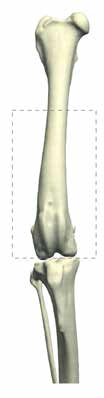 Тип 2
Тип 2 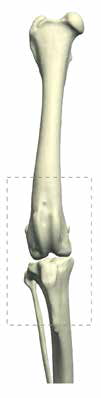 Тип 3
Тип 3 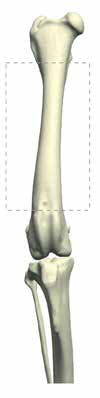
Рис. 8. 3 типа резекции НО при органосохраняющих операциях по Enneking [24]. Тип 1. Внутрисуставная (интраартикулярная)
резекция кости с одним смежным суставом. Тип 2. Внесуставная (экстраартикулярная) экстирпация кости с двумя смежными
суставами (удаляется единым блоком (en Bloc). Выполняется в случае проникновения опухоли в сустав при прямой перфорации
через суставную поверхность. Тип 3. Интеркалярная резекция опухоли в пределах кости (часть или целый диафизарный
сегмент)
Тип 1.
Внутрисуставная (интраартикулярная):
резекция кости с одним смежным суставом
Тип 2. Вне-суставная (экстраартикулярная): экстирпация кости с двумя смежными суставами (удаляется в едином блоке); Выполняется en Block резекция сустава с линиями резекции сегмента кости, выходящими за пределы сустава. Опухоль проникает в сустав путем прямой перфорации через суставную поверхность.
Тип 3. Интеркалярная: резекция опухоли в пределах кости (чаще диафизарный сегмент).
Реконструкция пострезекционного костного дефекта (пРКД).
Техники реконструкции пРКД при органосохранных операциях могут быть разнообразными. Крайне важно выбрать наиболее эффективный метод для конкретного пациента с наиболее низкой частотой осложнений.
В литературе описано множество способов и техник для замещения обширных костных дефектов после резекции ОС у животных с использованием аутокости, костного аллотрансплантата, пастеризованного аутотрансплантата, облученного реплантата, а также реплантация пораженного опухолью сегмента кости после замораживания в парах азота и облучения, транспозиция васуляризированного сегмента локтевой кости, стереотаксическая радиохирургия, использование дистракционного реплантата (дистракционный остеосинтез по методу Г.А. Илизарова), замещение металлическими эндопротезами (модульные системы используются в гуманной медицине, стальные, титановые), замещение индивидуально изготовленными эндопротезами (прецизионные) изготовленными с использованием аддитивных технологий, методики с применением реваскуляризированных трансплантатов, цементная пластика с стержне-винтовым армированием или без в сочетании с фиксацией мостовидной [2, 4, 8, 9, 23, 26]. За исключением интраоперационной радиотерапии и стереотаксической радиохирургии, большинство методов включают резекцию пораженной части кости. Стоит отметить, что использование же неваскуляризированной кости (аллотрансплантаты, облученный реплантат) на сегодняшний день связано с высоким риском инфицирования (более 50%) и не имеет широкого распространения в клинической практике [27, 28].
В современной онкоортопедии среди различных способов восстановления дефекта и функции конечности после удаления опухолевого очага лидирующие положения занимают высокотехнологические операции с использованием эндопротезов.
Эндопротезирование после резекции en Block первичной костной опухоли позволяет улучшить качество жизни пациентов в короткие послеоперационные сроки на фоне хорошего функционального результата.
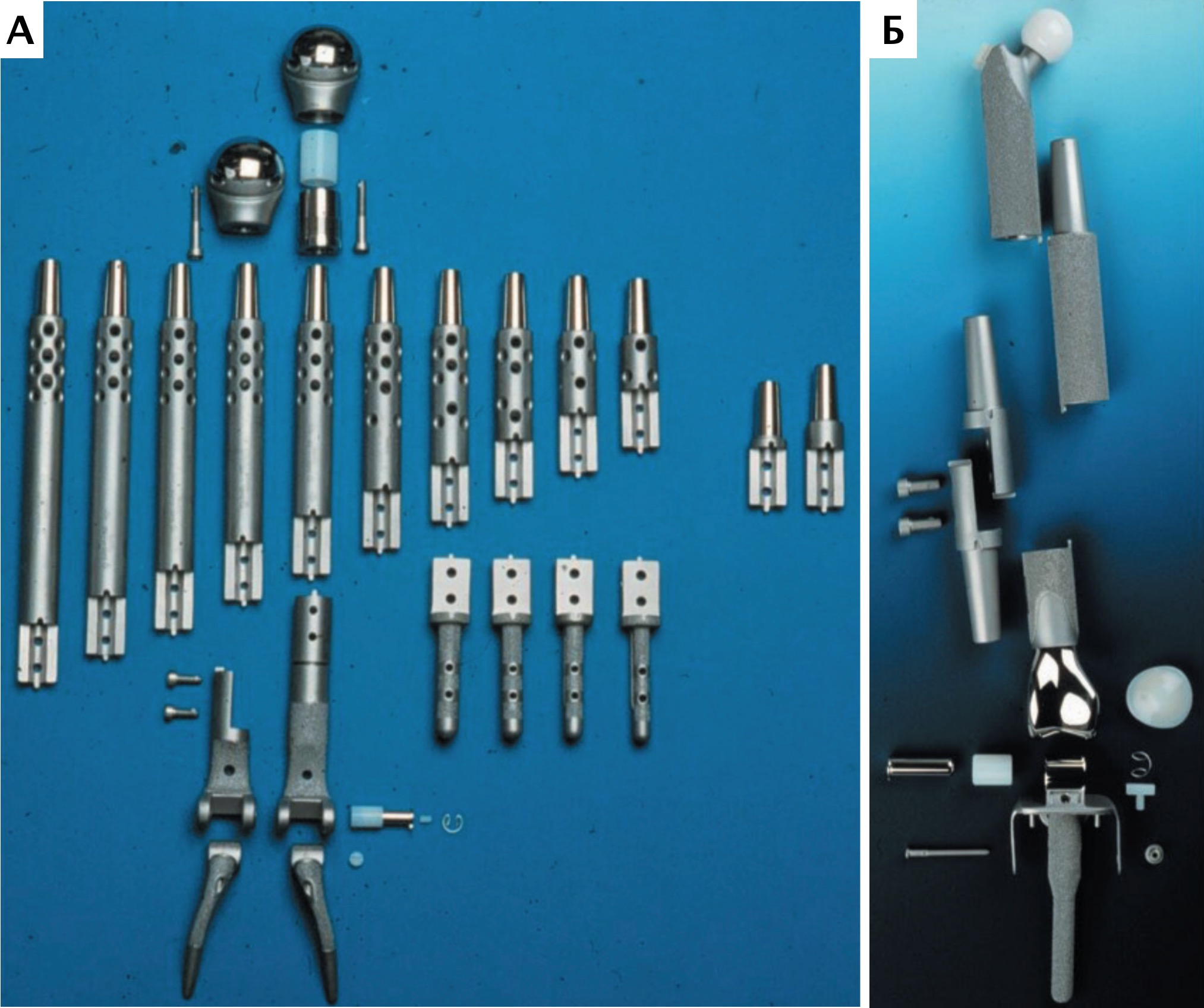
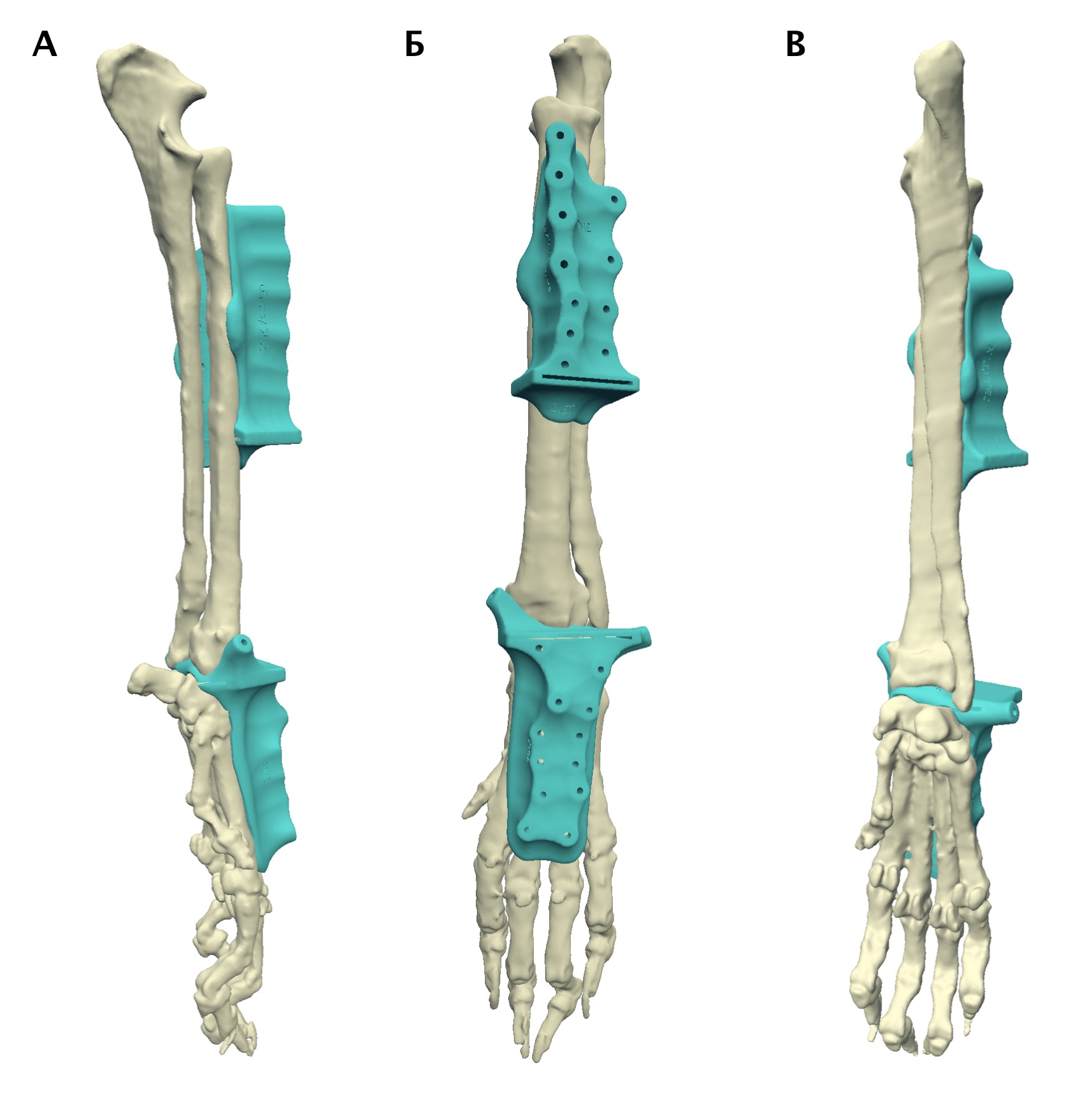
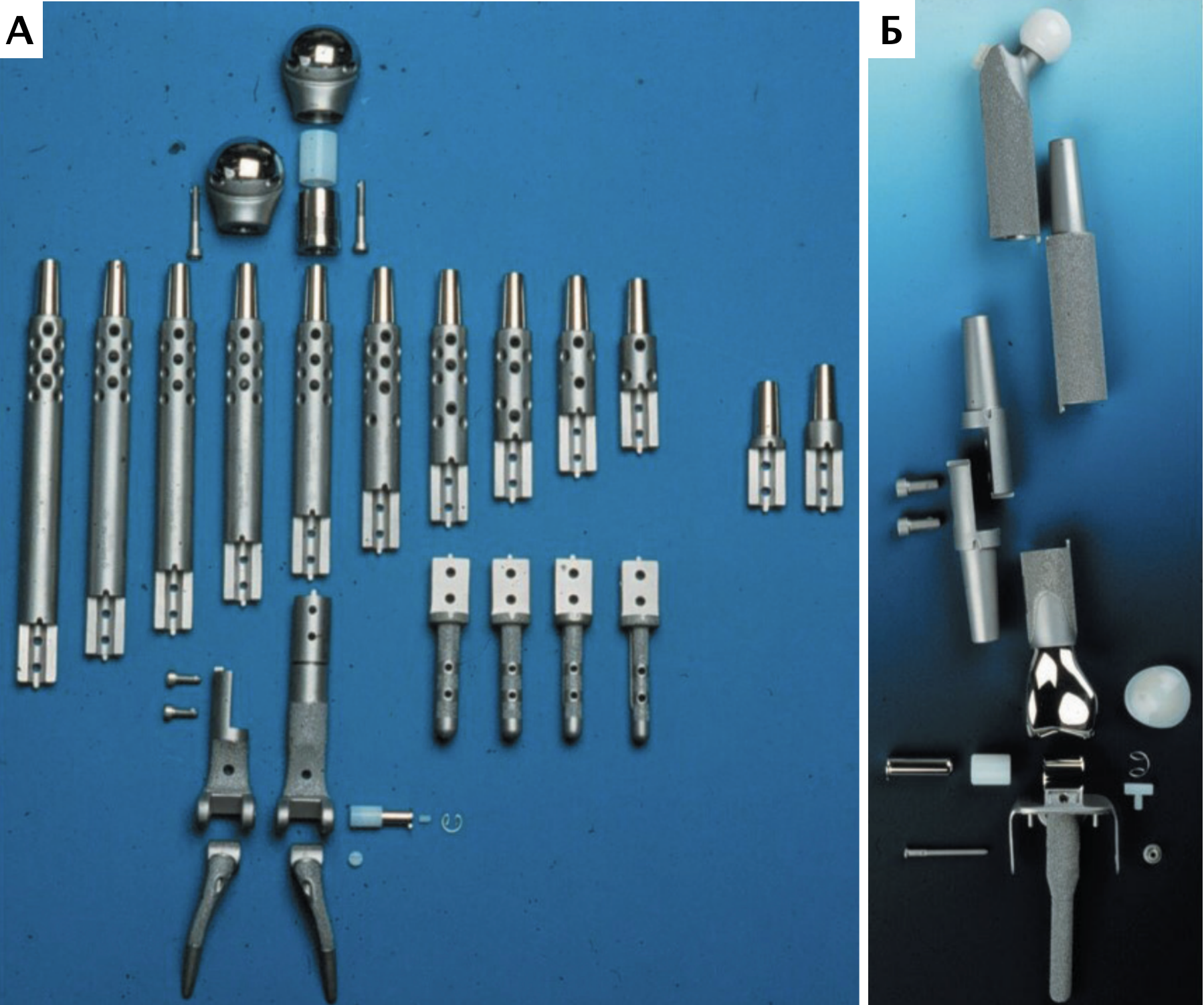
Согласно основным тенденциям эволюции эндопротезирования суставов и сегментов кости, использование модульных систем признано наиболее актуальным и современным, отвечающим основным требованиям, способом реконструкции костных дефектов при саркомах кости в гуманной медицине [9, 21] (рис. 9). В ветеринарной медицине на сегодняшний день нет коммерческих модульных систем для замещения пРКД, однако специальные металлические протезы для замещения пРКД при аппендикулярной ОС имеются.
А  Б
Б 
Рис. 9. Модульные системы протезирования, используемые для ОСО в гуманной медицине.
Системы для одномоментного тотального эндопротезирования плечевой кости
и плечевого сустава (А) и для тазобедренного, коленного суставов и бедренной кости (Б)
В гуманной онкоортопедии выделены основные принципы органосохраняющих операций [29]:
широкая резекция пораженной кости в мышечно-фасциальном футляре без вскрытия псевдокапсулы (en Block) с отступом 3-5 см;
удаление блоком всех мест предыдущих биопсий и других потенциально «загрязненных» тканей (принцип абластики);
наложение временного турникета проксимальнее поражения;
адекватная реконструкция при помощи перемещения регионарных мышц;
адекватное мягкотканое покрытие;
интраоперационная (экспресс) микроскопическая оценка исследования края резецированной кости.
Эндопротезы для замещения костных дефектов
Цель всех методик состоит в обеспечении наиболее эффективного способа сохранения опорной функции конечности после перенесенной ОСХ [12]. При биомеханическом сравнительном исследовании коммерческих имплантатов (эндопротезов) из нержавеющей стали для собак (Veterinary Orthopedic Implants, Burlington, VT; GEN1) и кортикальных аллотрансплантатов, было выявлено, что конструкции эндопротезов были значительно стабильнее и превосходили по жесткости аллотрансплантаты кортикальных костей при аксиальной компрессии и при тестировании на состоятельность фиксации [28]. Пациенты с замещением костного дефекта эндопротезом имели схожие результаты с показателями инфицирования – 60%, несостоятельность фиксации – 40% и местный рецидив – 20%. Тогда как собаки с замещением дефекта аллотрансплантатом имели сопоставимые показатели осложнений 50%, 40% и 10% соответственно [29, 2]. Функция конечности была оценена как хорошая у 80% собак с эндопротезом и в 70% собак с аллотрансплантатом коры [2, 28].
Стоит отметить, что на сегодняшний день в ветеринарной медицине нет статистически достоверных результатов, что один из методов превосходит другой при ОСХ, так как каждый из них имеет свой определенный спектр преимуществ, а также осложнений.
Показания для проведения ОСХ:
первичные костные НО апендикулярного скелета (Withrow & Vail 2007);
отсутствие выявленных макрометастазов;
отсутствие сопутствующих выраженных ортопедических и неврологических заболеваний (остеоартрит, дегенеративный пояснично-крестцовый синдром) [6, 2];
пораженный ОС сегмента не более < 50% от длины кости (Withrow&Vail, 2007) [32];
отсутствие выраженной инвазии в окружающие мягкие ткани.
Особенности хирургической техники при ОСХ:
резектабельная локализация НО, что позволяет выполнить полную резекцию пораженного сегмента кости. Как правило это области предплечья, голени. (прим. ОСО при ОС плечевой и бедренной костей имеют большее число осложнений);
отказ владельцев от ампутации;
отсутствие патологического перелома [2, 23]. На сегодняшний день данный тезис пересматривается, так как у людей наличие ПП не является противопоказанием к ОСО [27] (более подробно см. ниже).
Широкая сегментарная резекция. Требуется выполнять резекцию с минимальным отступом от предполагаемого края опухоли не менее 3-5 см (при условии отсутствия распространения опухоли в костномозговом канале оставшейся части кости) [21] (Dernell 2003; Liptak et al., 2004b; Dernell et al., 2007).
Оценка края резекции. После выполнения проксимальной остеотомии выполняется забор костного мозга из ИМ канала для исследования на предмет инвазии ОС для оценки «чистоты» края резекции [9].
Сохранение перфузии тканей и контроль гемостаза при выполнении ОСХ при отсутствии инвазии магистральных сосудов.
Противопоказания и ограничения к ОСХ:
патологический перелом кости при ОС, ранее постулировался как противопоказание к выполнению ОСХ т.к. присутствует контаминация окружающих тканей [9] (Scully et al. 2002; Ebeid et al. 2005). На сегодняшний день данный тезис пересматривается в ветеринарной медицине, в связи с тем, что у людей наличие ПП не является противопоказанием к проведению ОСО так как по результатам исследований проведение ОСО при наличии патологических переломов дает аналогичный долгосрочный прогноз как и при ампутации конечности [17, 27] (Jeon et al., 2009). Также по результатам двух ветеринарных исследований было продемонстрировано, что ОСО может быть выполнена у пациентов с патологическими переломами, являясь альтернативой ампутации с целью купирования болевого синдрома в качестве паллиативной меры и с достижением длительного выживания у некоторых пациентов (Bhandal and Boston 2011; Boston et al. 2011). Контаминация при ПП также может быть уменьшена при использовании лучевой терапии и неоадъювантной химиотерапии [4];
значимое вовлечение мягкотканного компонента, магистральных сосудов и нервов и невозможность проведения реконструкции и укрытие дефекта мягкими тканями с формированием мышечного футляра вокруг трансплантата. По опыту авторов при наличии достаточного количества кожи даже без мышечного компонента и при отсутствии натяжения, можно выполнить закрытие операционной раны с ушиванием подкожной жировой клетчатки и кожи и добиться оптимальных результатов без развития значимых осложнений.
отказ владельцев от ОСО;
наличие распада опухоли и кровотечение.
Провести сравнительную оценку 3-х хирургических техник органосохранных операций с замещением пострезекционных дефектов кости после сегментарной резекции при аппендикулярной остеосаркоме предплечья у 3-х собак.
Материалы и методы
Материалом исследования в период с января 2016 г. по июль 2018 г. послужили три собаки (n=3): пациент №1, метис, самец, 10 лет (вес 54 кг.); пациент №2, кане-корсо, самец, 9.5 лет (вес 47 кг.); пациент №3, родезийский риджбек, самка, 2 года (вес 35 кг.). Все животные поступили в ветеринарную клинику «Бэст» (Новосибирск).
Оцениваемые данные включали следующие параметры: масса тела, клинические симптомы, оценку пред- и послеоперационной хромоты, активность сывороточной щелочной фосфатазы (ЩФ), проводимую терапию перед операцией, описание техники операции и типа эндопротеза, используемого для реконструкции костного дефекта, химиотерапию, послеоперационные осложнения, метастазы, информацию о продолжительности жизни в 2-х случаях.
Поводом для обращения во всех случаях была прогрессирующая хромота разной степени выраженности. Оценка тяжести хромоты в пред- и послеоперационный периоды была выполнена с помощью 5-и балльной шкалы по Innes J (Vet Rec 2003) (табл.1). В двух случаях (№1, №3) пациенты имели хромоту по типу висячей конечности (степень 5). В одном случае (№2) – степень 4.
Общий осмотр. Без отклонения, подмышечные лимфатические узлы при физикальном обследовании во всех случаях были интактны.
Ортопедический осмотр. Отмечена выраженная болезненность при пальпации и увеличение конечности в объеме в двух случаях в области дистального сегмента лучевой кости (№1;3) в одном случае в области диафизарного сегмента локтевой кости (№2).
Все пациенты имели визуальное увеличение объема конечности при физикальном обследовании и выраженный болевой синдром при глубокой пальпации. В ранний п/о период контроль осуществлялся посредством повторного приема пациента. В отдаленный п/о период (через 4/6/8/10 месяцев согласно протоколу оценки) контроль осуществлялся методом телефонного обзванивания владельцев через call-центр, а также с помощью видеозаписи опороспособности пациента дистанционно.
Протокол предоперационного обследования во всех случаях включал: стандартное ортопедическое обследование, рентгенографическое исследование (EXAMION DR 810 Case Solution/Examion® Maxivet FPS (DR 1417) пораженной конечности и грудной клетки в 2-х взаимно перпендикулярных плоскостях, общий и биохимический анализы крови (оценка щелочной фосфатазы), УЗИ сердца и брюшной полости. Компьютерная томография (КТ) была выполнена на аппарате Siemens SOMATOM Emotion.
|
Таблица 1. Система оценки хромоты (Innes J; Vet Rec 2003). | ||
|
Степень хромоты |
После нагрузки |
Степень боли |
|
1 – отсутствие хромоты |
Отсутствие хромоты. |
Отсутствует боль при манипуляции с суставом. |
|
2 – легкая хромота |
Прогулка преимущественно без хромоты, после длительной нагрузки незначительная хромота. В стоячем положении патологическая осанка, может не полностью нагружать пораженную конечность. |
Незначительный дискомфорт при манипуляции с суставом. |
|
3 – умеренная хромота |
Перемежающая хромота, появляющаяся после длительной прогулки. |
Умеренный болевой синдром при манипуляции с суставом. |
|
4 – средняя хромота |
Постоянная хромота на прогулке. |
Сильный болевой синдром при манипуляции с суставом. |
|
5 – тяжелая хромота |
Отсутствие полноценной опоры, в ряде случаев нет опоры на пораженную конечность. |
Выраженный болевой синдром при манипуляции с суставом. |
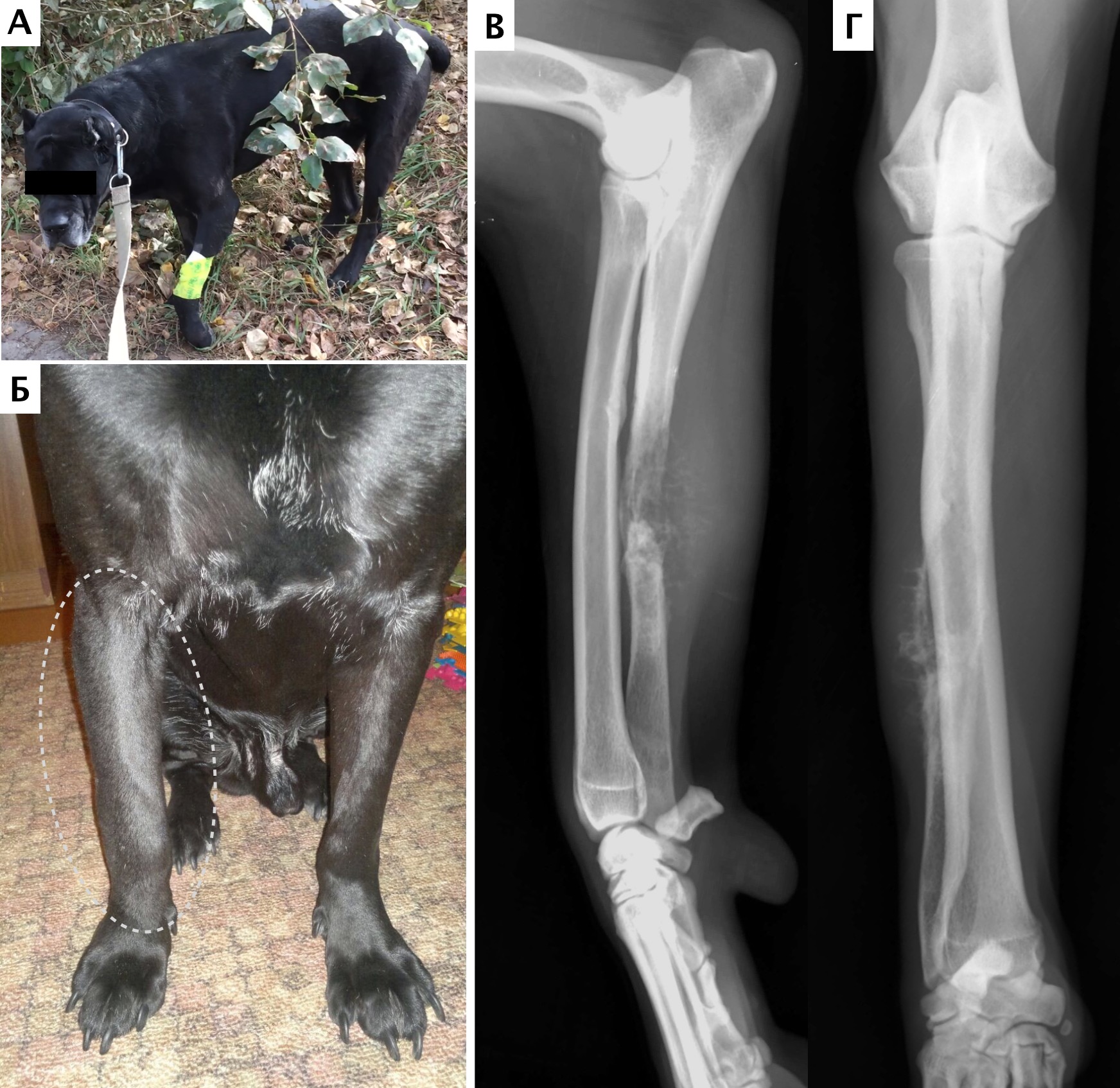
А
В двух случаях по данным РТГ и КТ исследований были выявлены периостальная реакция и очаговая остеодеструкция дистального сегмента лучевой кости (пациенты №1, №3) в одном случае аналогичные изменения диафизарного сегмента локтевой кости (№2) (рис. 10, 11, 12) Для исключения отдаленного метастазирования выполняли КТ-онкопоиск (с контрастом) с оценкой пораженного сегмента НО и оценкой протяженности ОС в ИМ канале. Метастатических поражений не было выявлено, региональные л/у по данным КТ и данным физикальной оценки были интактны у всех пациентов.
А  Б
Б 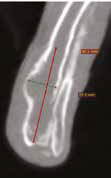 В
В 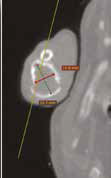 Г
Г 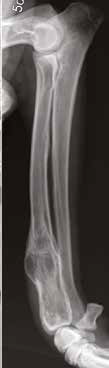 Д
Д 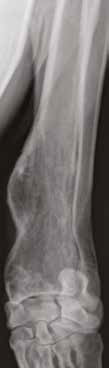
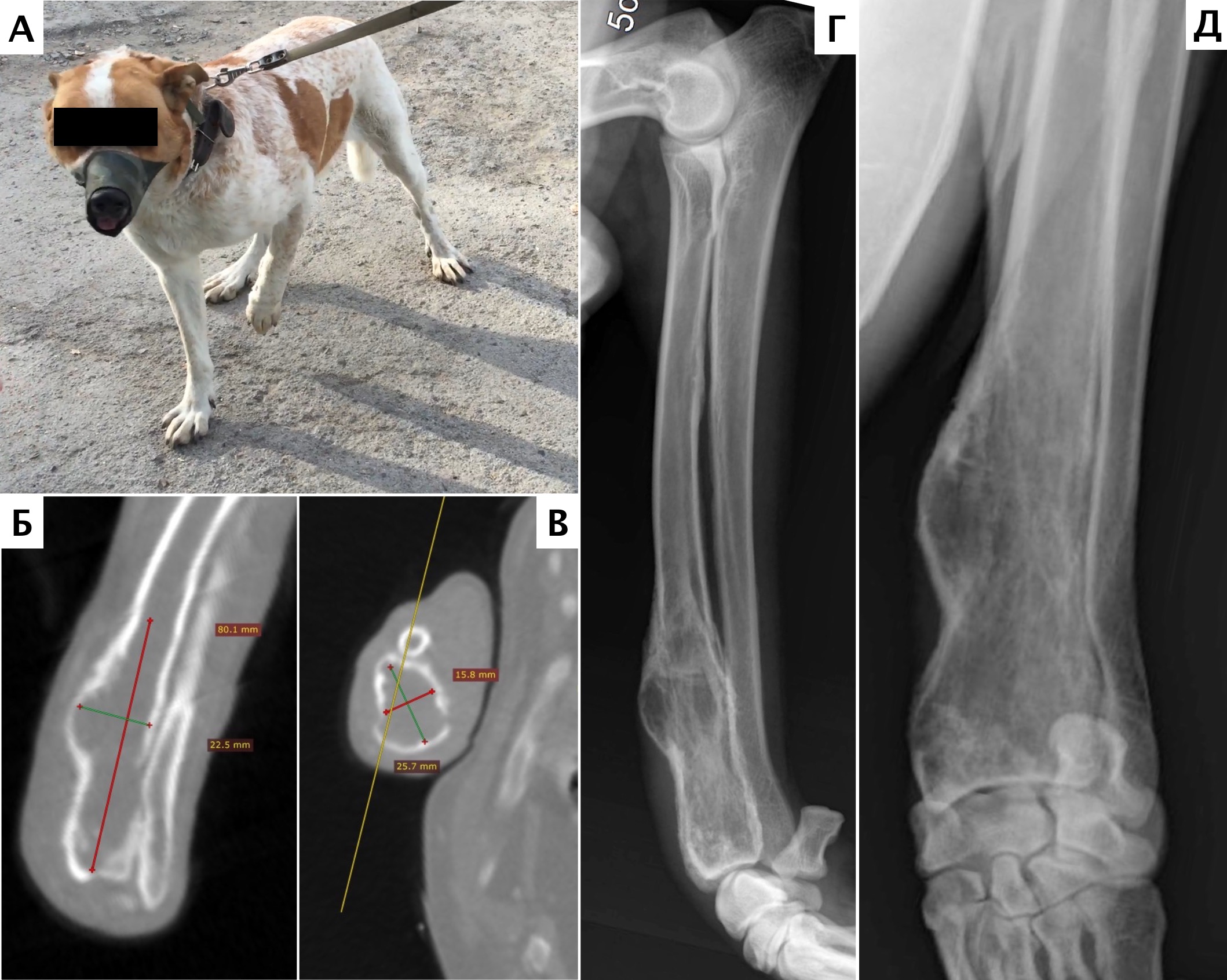
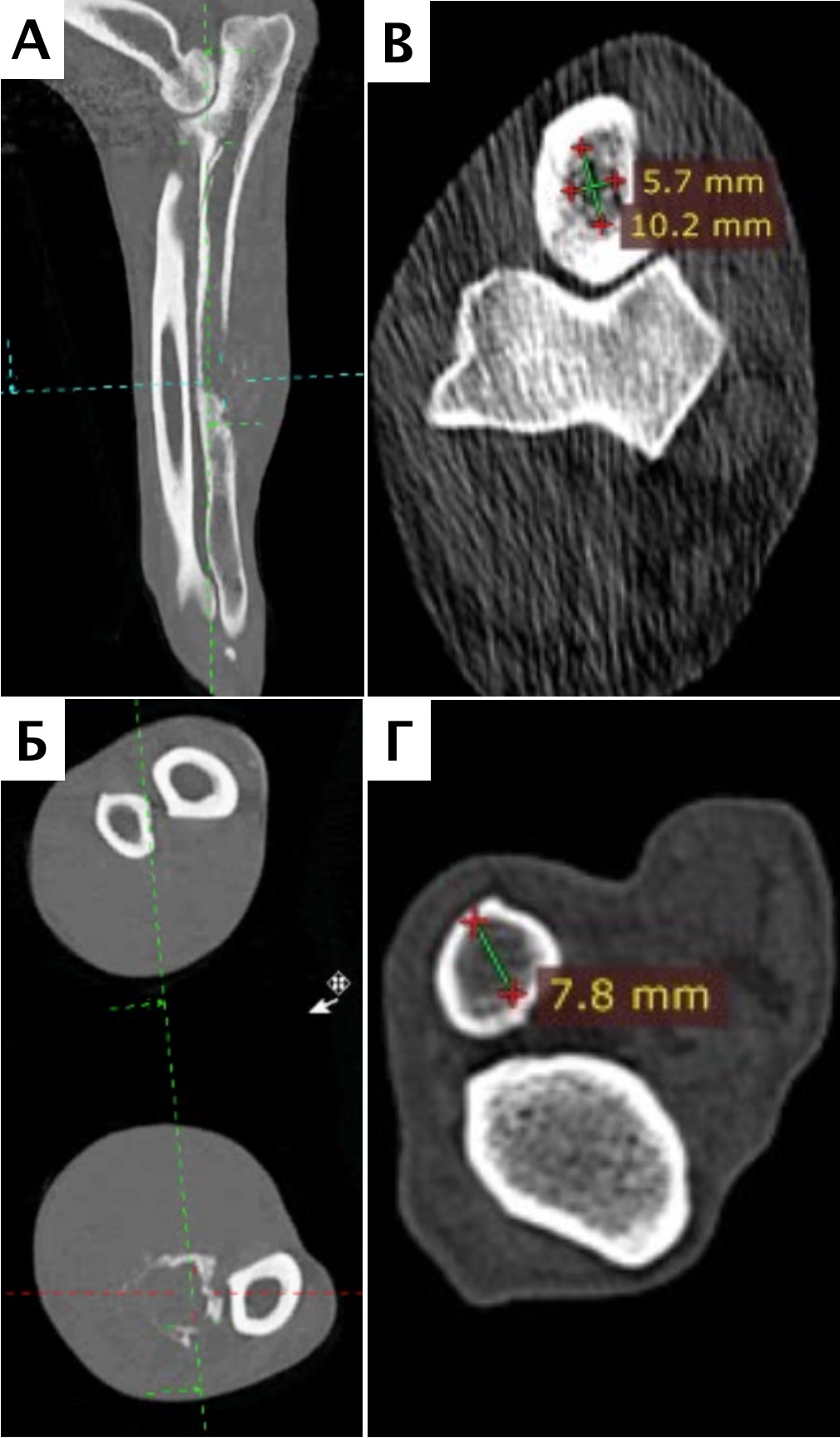
Рис. 10. А – Пациент №1. Отмечается хромота 5-й степени. Б, В – сагитальный, аксиальный КТ-срезы пациента на уровне дистального сегмента предплечья. По результатам КТ грудных
конечностей была выполнена оценка и планирование уровня резекции перед органосохранной операцией. Г, Д – медиолатеральная и краниокаудальная рентгенограммы грудной конечности
с ОС дистального сегмента лучевой кости. Уровень периостальной реакции по данным КТ имеет большую протяженность в сравнении с данными рентгенологического исследования (Г, Д)
Двум пациентам выполняли чрескожную КТ управляемую трепанобиопсию кости под общей анестезией (использовали иглы типа Ямшиди) с последующим гистологическим исследованием (рис. 13). Стадирование опухолевого процесса определяли на основании клинической классификации по стадиям Enneking (Enneking 1980).
А 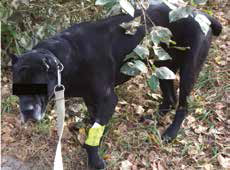 Б
Б 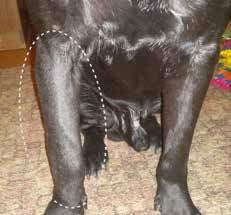 В
В 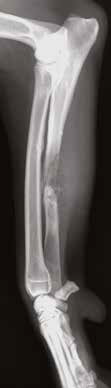 Г
Г 
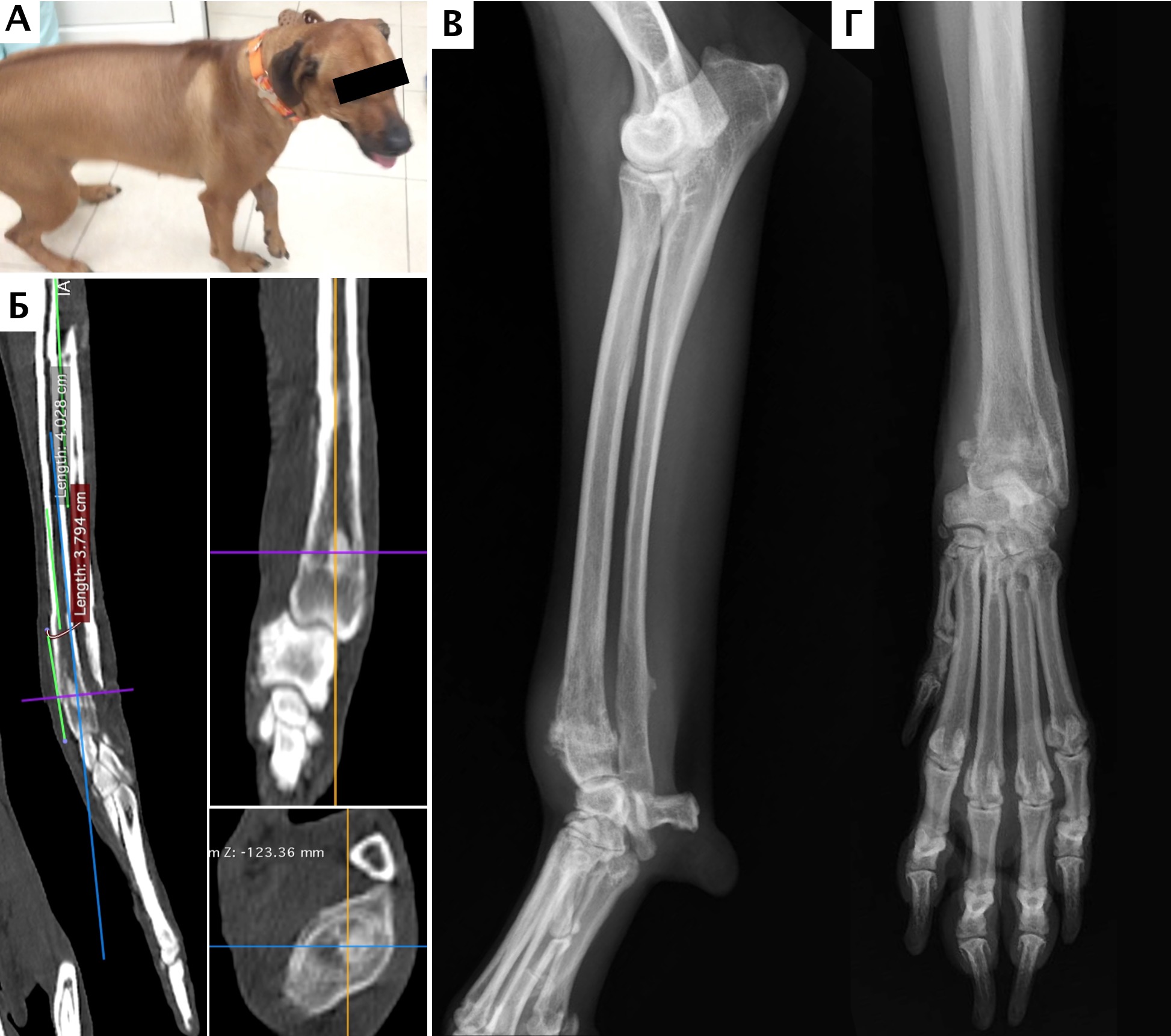
Рис. 11. А – Пациент №2. Б – отек области предплечья справа. В – медиолатеральная
и краниокаудальная рентгенограммы предплечья. Отмечается остеолитическое поражение
диафизарного сегмента локтевой кости
Во всех случаях предоперационное планирование и определение уровня резекции выполнялось на основании данных КТ. Оценивались следущие параметры: уровень резекции НО на основании остеолизиса кости, протяженности периостальной реакции и видимая инвазия опухоли в интрамедуллярном канале (минимальный отступ 4 см) в артериальную фазу КТ исследования, замеры ИМ канала лучевой и локтевых костей для изготовления индивидуального имплантата (пациент №3) и для подбора ИМ блокируемого стержня (пациент №2), ширина предполагаемого сохранного костного сегмента для расположения экстрамедуллярной части имплантата при планировании эндопротезирования (на уровне проксимального сегмента лучевой кости после остеотомии у пациента №3) и оценка объема костного дефекта для последующей реконструкции во всех случаях. Стоит отметить, что во всех случаях по результатам КТ была выявлена периостальная реакция и поражение костной ткани на большем протяжении, чем было выявлено изначально по данным рентгенографии. Однако по некоторым данным КТ переоценивает степень вовлеченности кости на 27%, что необходимо учитывать [9]. Послеоперационно была выполнена рентгенография резецированного сегмента на предмет оценки уровня резектабельности.
А 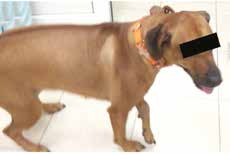 Б
Б 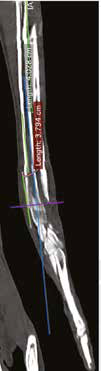
 В
В 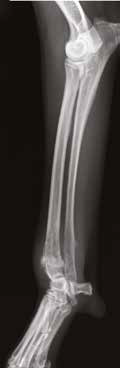 Г
Г 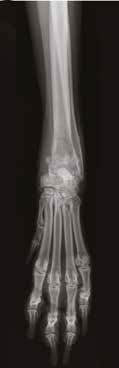
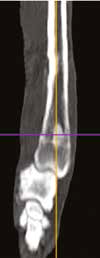
Рис. 12. А – Внешний вид пациента №3. Отмечается хромота 5-й степени. Б – КТ-срезы на уровне дистального
сегмента лучевой кости пораженного ОС. Планирование уровня резекции с отступом 4-5 см.
В, Г – ОС дистального сегмента лучевой кости (отмечается периостальная реакция и остеодеструкция)
Периоперационную антибиотикопрофилактику выполняли с использованием препарата синулокс (20 мг/кг, однократно) за 30 минут до оперативного доступа. При увеличении времени оперативного вмешательства (более 90 минут с момента оперативного доступа), повторно вводили препарат. Далее продолжали антибиотикотерапию в том же режиме дозирования 2 раза в день курсом от 3-6 недель). Периоперационная анальгезия включала: фирококсиб в дозе 7 мг/кг, 2 раза в день до 3-х недель и габапентин 10 мг/кг, 2 раза в день, курсом 2 недели.
А 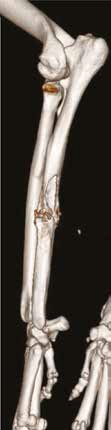 Б
Б 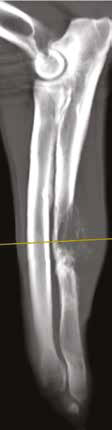 В
В 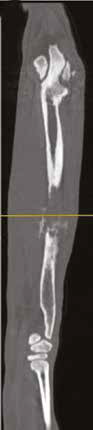 Г
Г 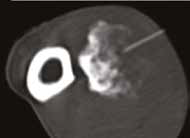 Д
Д 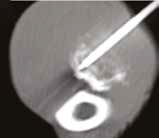 Е
Е 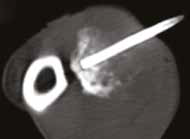 Ж
Ж 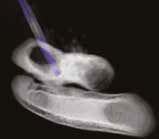
З 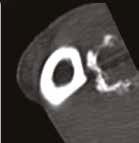 И
И 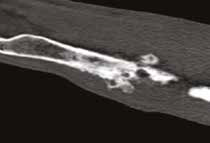
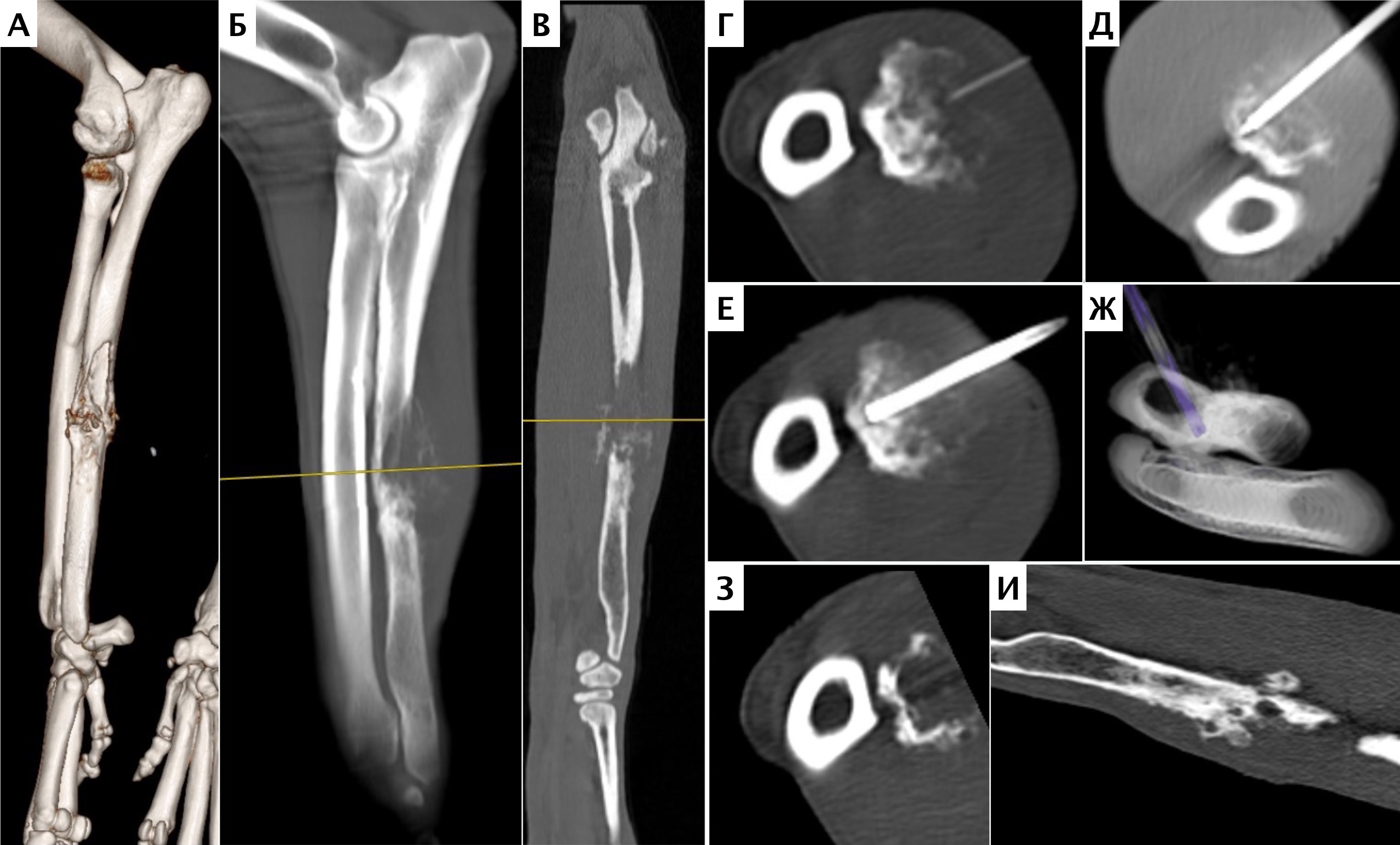
Рис. 13. Пациент №2. Процедура чрескожной трепанобиопсии кости под контролем КТ. А – 3D-вид локтевой кости с ОС с выраженной
остеодеструкцией. Б, В – сагиттальный и дорсальный КТ-срез предплечья на уровне остеолитического поражения диафизарного сегмента
локтевой кости. Г – первый аксиальный прицельный скан с введением иглы 23G для дальнейшего позиционирования трепана (иглы Ямшиди);
Д, Е, Ж – параллельное введение трепана (иглы Ямшиди) с двукратным забором материала; З, И – оценка хода иглы после забора материала
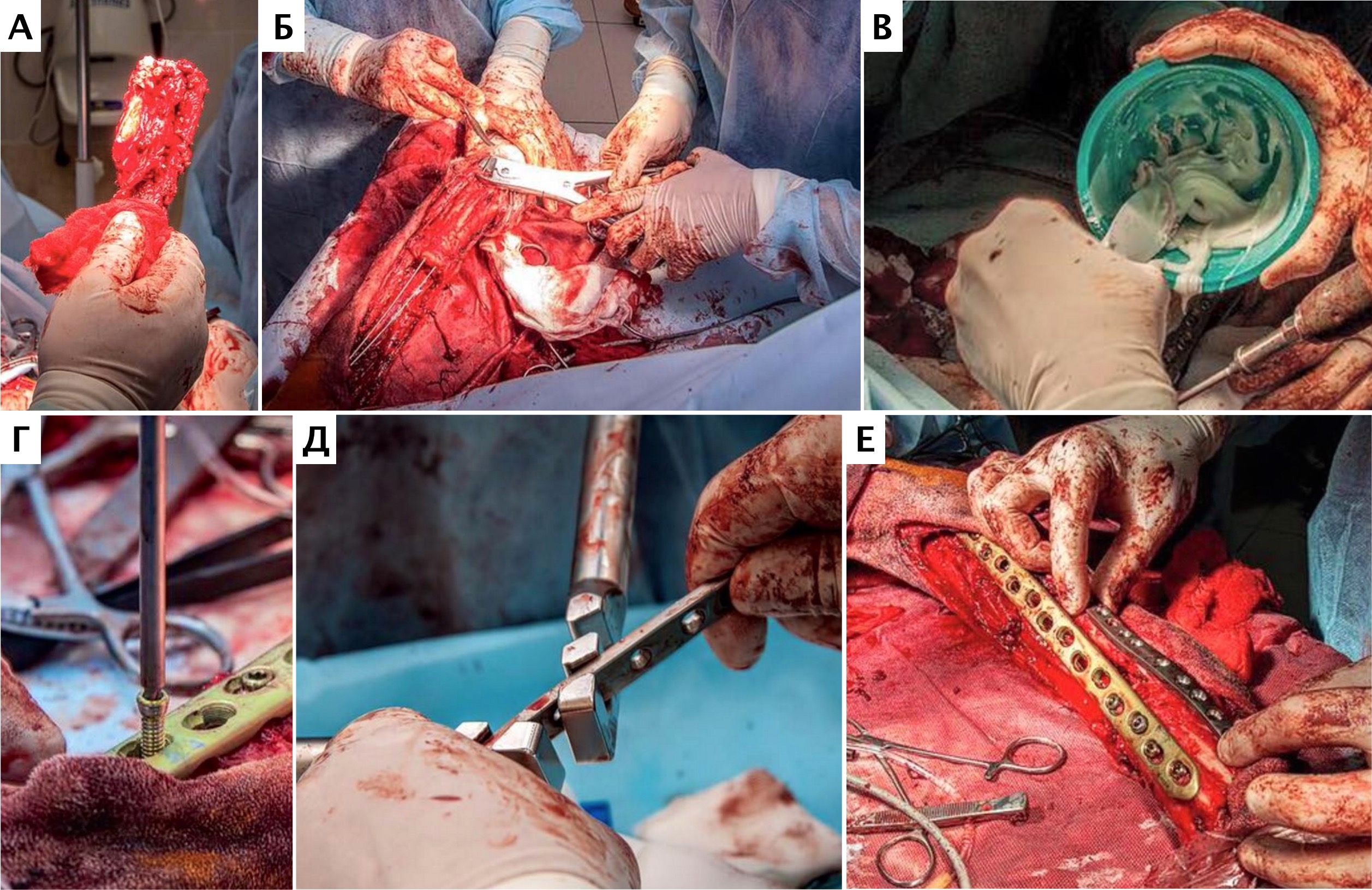
Во всех случаях на первом этапе операции выполняли сегментарную резекцию НО, с отступом 3-5 см. от видимого очага остеодеструкции. После удаления НО кости выполнялся интраоперационный рентген – контроль для оценки проксимальных границ резекции НО.
На втором этапе операции выполняли одномоментную реконструкцию костного дефекта. Стоит отметить, что при выполнении ОСХ степень подготовки с соблюдением принципов асептики, антисептики должна быть аналогична протоколу для тотального эндопротезирования [9, 11].
Хирургические техники включали: выполнение широкой сегментарной резекции пораженного участка кости с одномоментной реконструкцией – замещением дефекта костным цементом (полиметиолметилметакрилат; ПММА) армированным спицами Киршнера с последующей фиксацией двумя пластинами (техника double plating) краниальной LCP и латеральной LC-DCP пластиной с формированием полного артродеза запястья (техника №1); замещение дефекта блокируемым интрамедуллярным стержнем (техника №2); замещение дефекта индивидуальным (персонифицированным) эндопротезом, изготовленным методом 3D-печати с применением аддитивных технологий с формированием полного артродеза запястья.
Для предоперационного планирования (пациент №3) с разработкой модели и последующей 3D-печати эндопротеза и индивидуальных ПХН использовалось программное обеспечение Polygon Medical Engineering. Используемое оборудование для 3D-печати металлом: аддитивная машина (3D-принтер) Concept Laser M2 Сusing с технологией (Laser CUSING (SLM – Selective Laser Melting) лазерного селективного плавления металлических порошков (выборочная лазерная плавка) с использованием материала титановый сплав ((Ti6AI4V), класс металлообработки – 5).
Изготовление прототипов костей и индивидуальных одноразовых ПХН для проведения остеотомии и последующего введения винтов, выполняли методом стереолитографиии (3D-печати) используя 3D-принтер Formlabs Form 2. из биосовместимого фотополимера Dental SG.
Используемые имплантаты и хирургическая техника
Пациент №1
Локализация НО – дистальный сегмент лучевой кости.
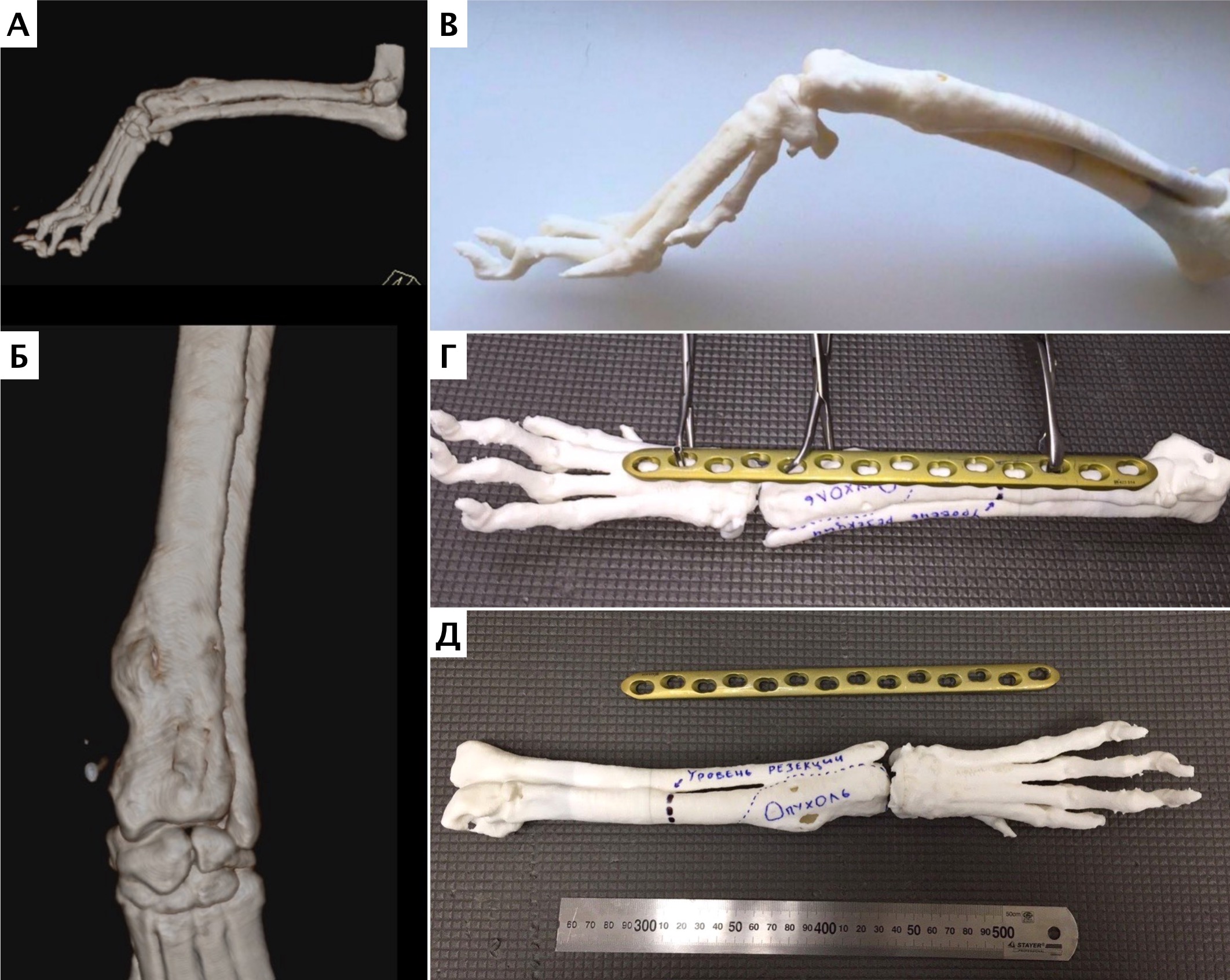
По данным РТГ и КТ исследований выявлены периостальная реакция и очаговая остеодеструкция дистального сегмента лучевой кости (пациент №1). В первом случае (пациент №1) предоперационно для отработки техники операции, предоперационного моделирования LCP пластины и оценки позиционирования имплантатов, была выполнена 3D-печать (прототипирование) пораженной грудной конечности методом послойного наплавления (FDM), с ипользованием материала ABS-пластик (рис. 14). Методика включала экспорт исходных КТ данных (DICOM файлы) в программу Inobitec Dicom Viewer. После создания цифровой 3D-модели пораженной ОС конечности, было выполнено создание STL-файла (стереолитография), который используется в качестве чертежа для построения уже физической модели (пластиковая модель – копия) методом 3D-печати.
А 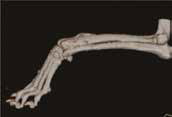 В
В 
Б 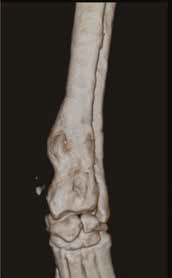 Г
Г  Д
Д 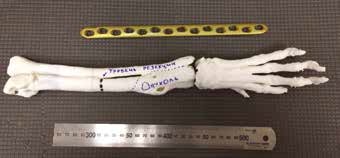
Рис. 14. Пациент №1. Предоперационное планирование ОСО. А, Б – Цифровая 3D-модель сегмента предплечья с ОС
и напечатанный на 3D-принтере пластиковый образец (В,Г,Д) кости размером 1:1.
Г, Д – моделирование LCP-пластины и оценка ее позиционирования на кости
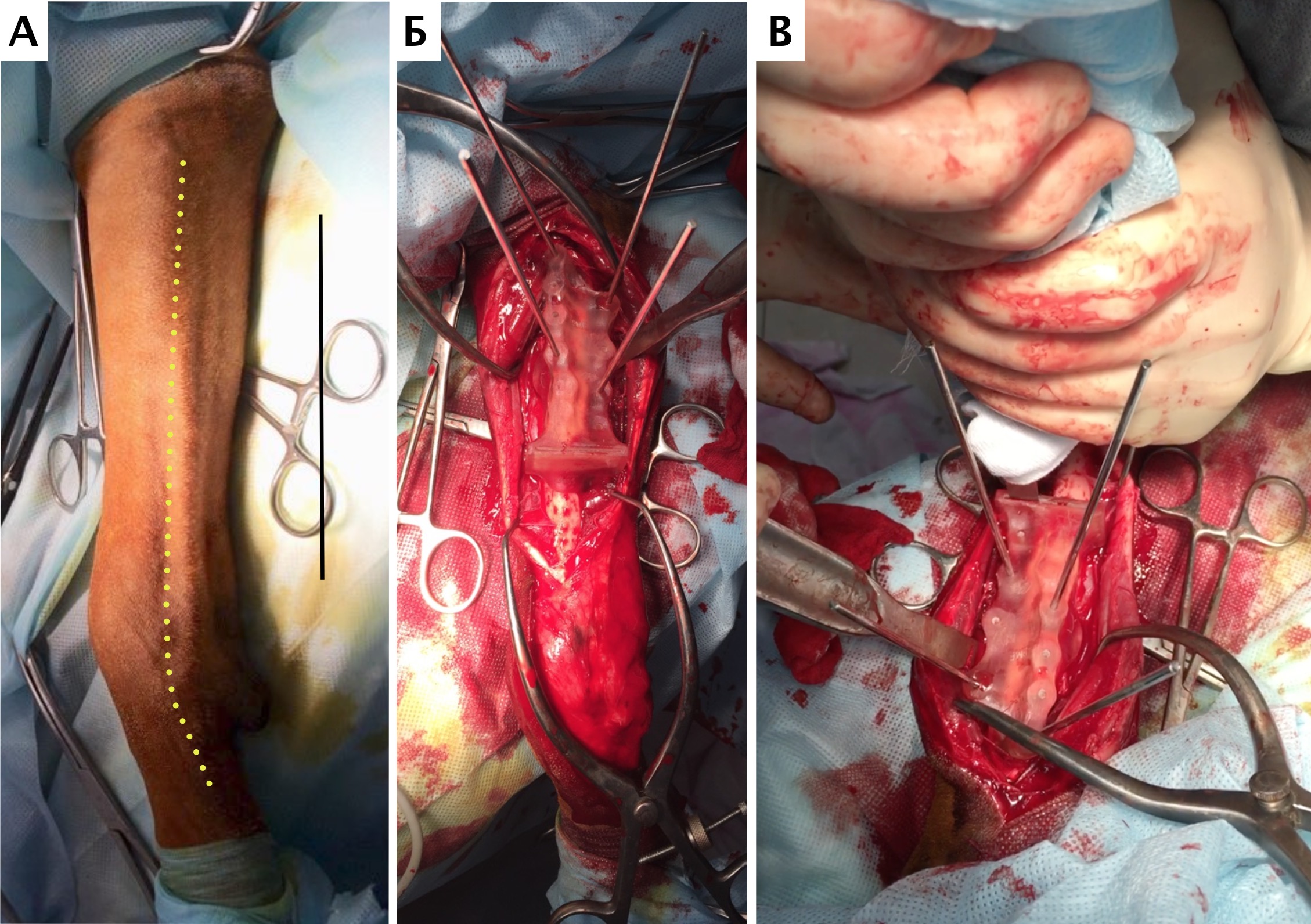
Основные интраоперационные этапы включали: оперативный доступ – краниолатеральный от локтевого сустава до костей пясти с сохранением латеральной вены предплечья. Далее была выполнена широкая сегментарная резекция пораженной кости в мышечно-фасциальном футляре без вскрытия псевдокапсулы (en Block) с иссечением области проведения чрескожной КТ управляемой трепан-биопсии, с отступом 4,5 см от видимого очага остеодеструкции. Область отступа (опила) для проверки измерений отмерялась от линии дистального (запястного) сустава. После выполнения проксимальной остеотомии был выполнен забор костного мозга из ИМ канала проксимального сегмента кости для оценки «чистоты» границ резекции. Далее выполняли артротомию на уровне запястно-пястного сустава с последующей дистальной остеотомией части центральной кости запястья с удалением суставного хряща. После «вычленения» пораженного сегмента кости и его последующего удаления выполнялась одномоментная реконструкция костного дефекта.
А 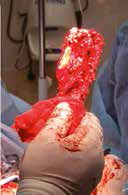 Б
Б 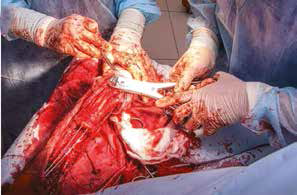 В
В 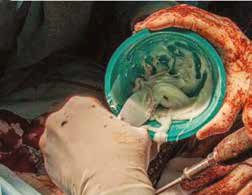
Г 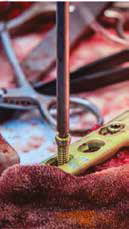 Д
Д 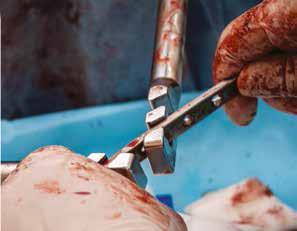 Е
Е 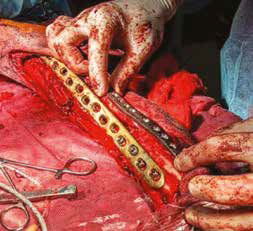
Рис. 15. Пациент №1. А – Резекция дистального сегмента лучевой кости единым блоком, проведение спиц Киршнера (Б) и формирование
армированного костно-цементного протеза (В) с последующей фиксацией LCP-пластины (Г). Д – моделирование второй LC-DCP пластины
и установка на локтевую кость в латеральном положении (Е)
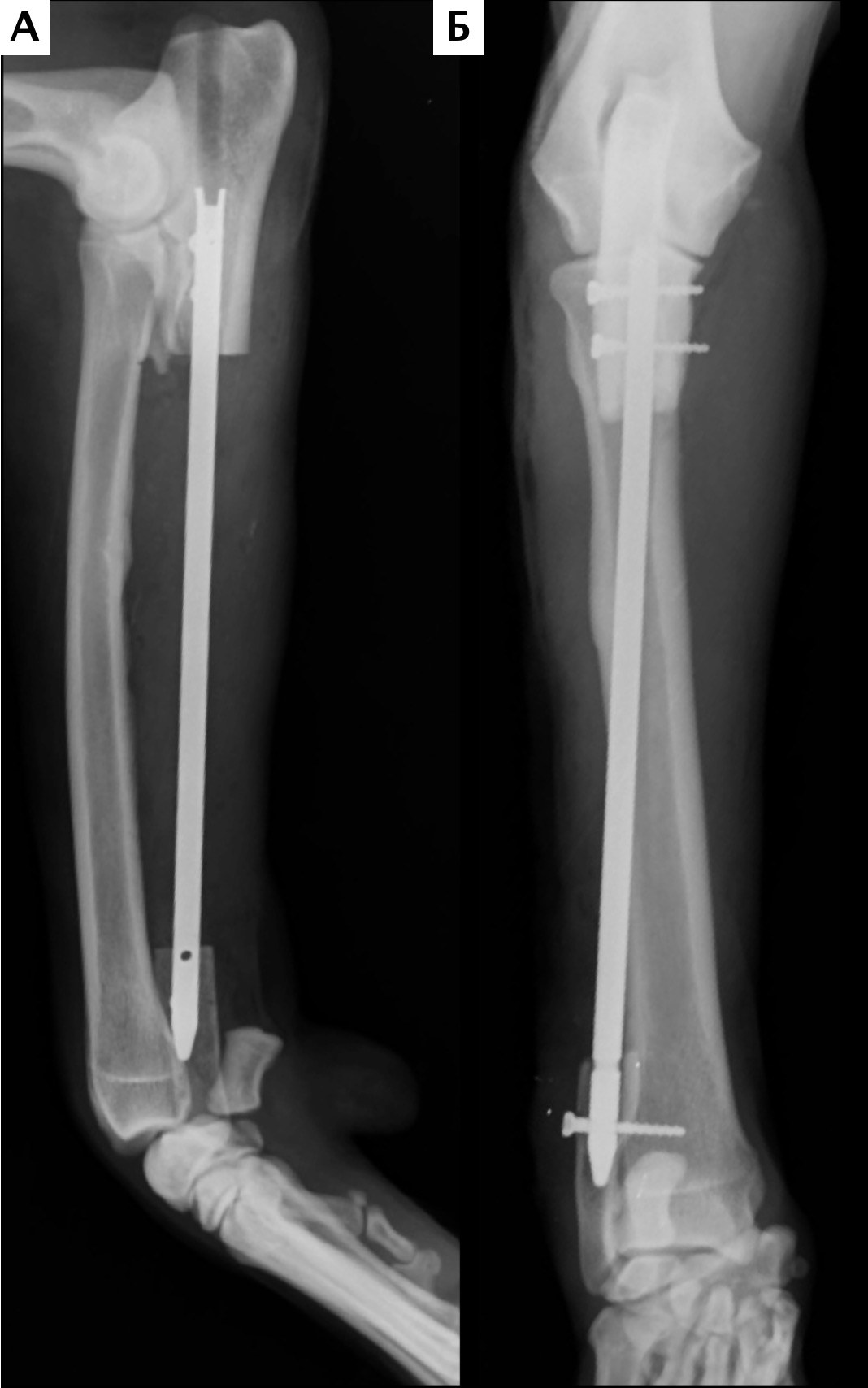
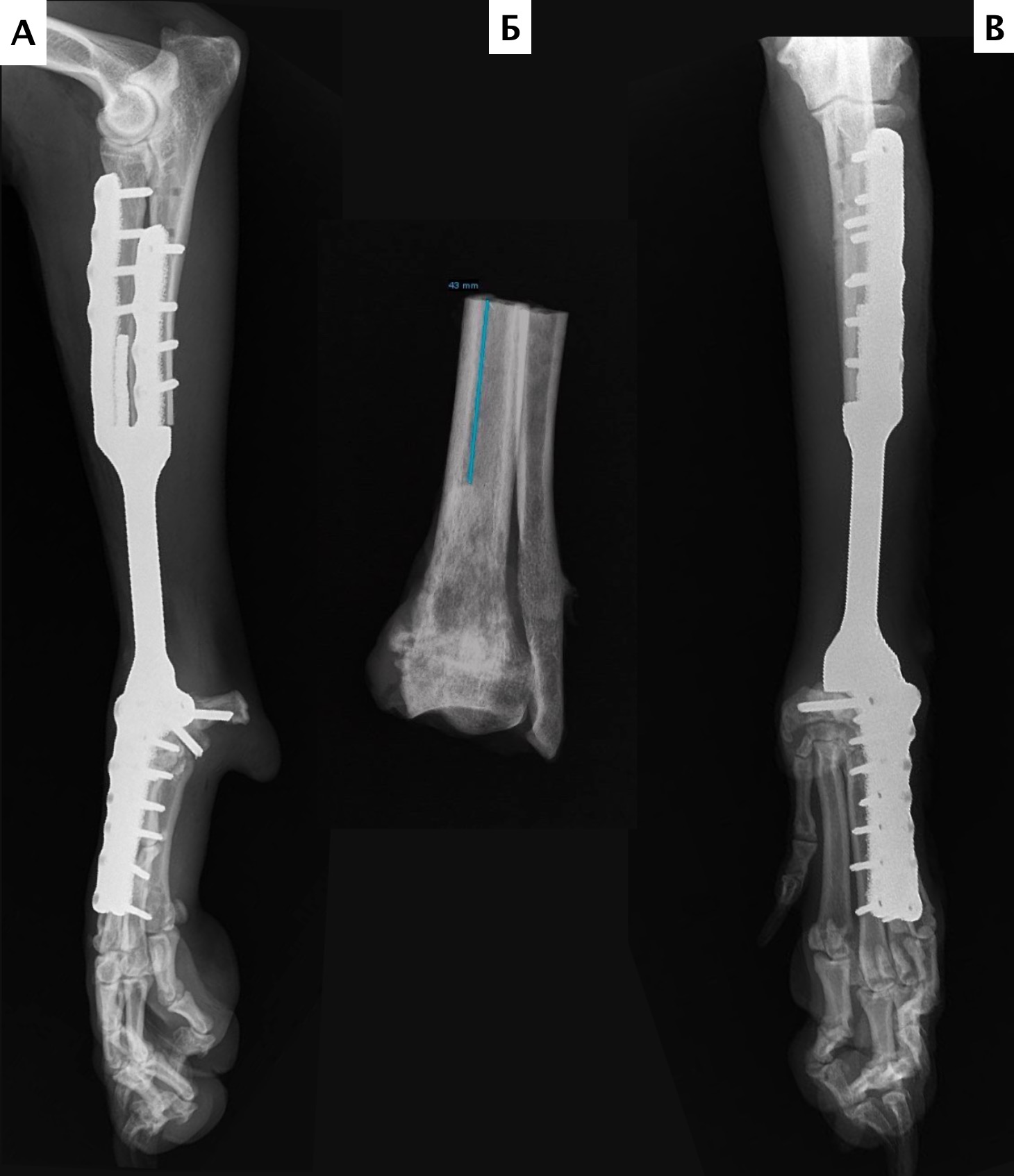
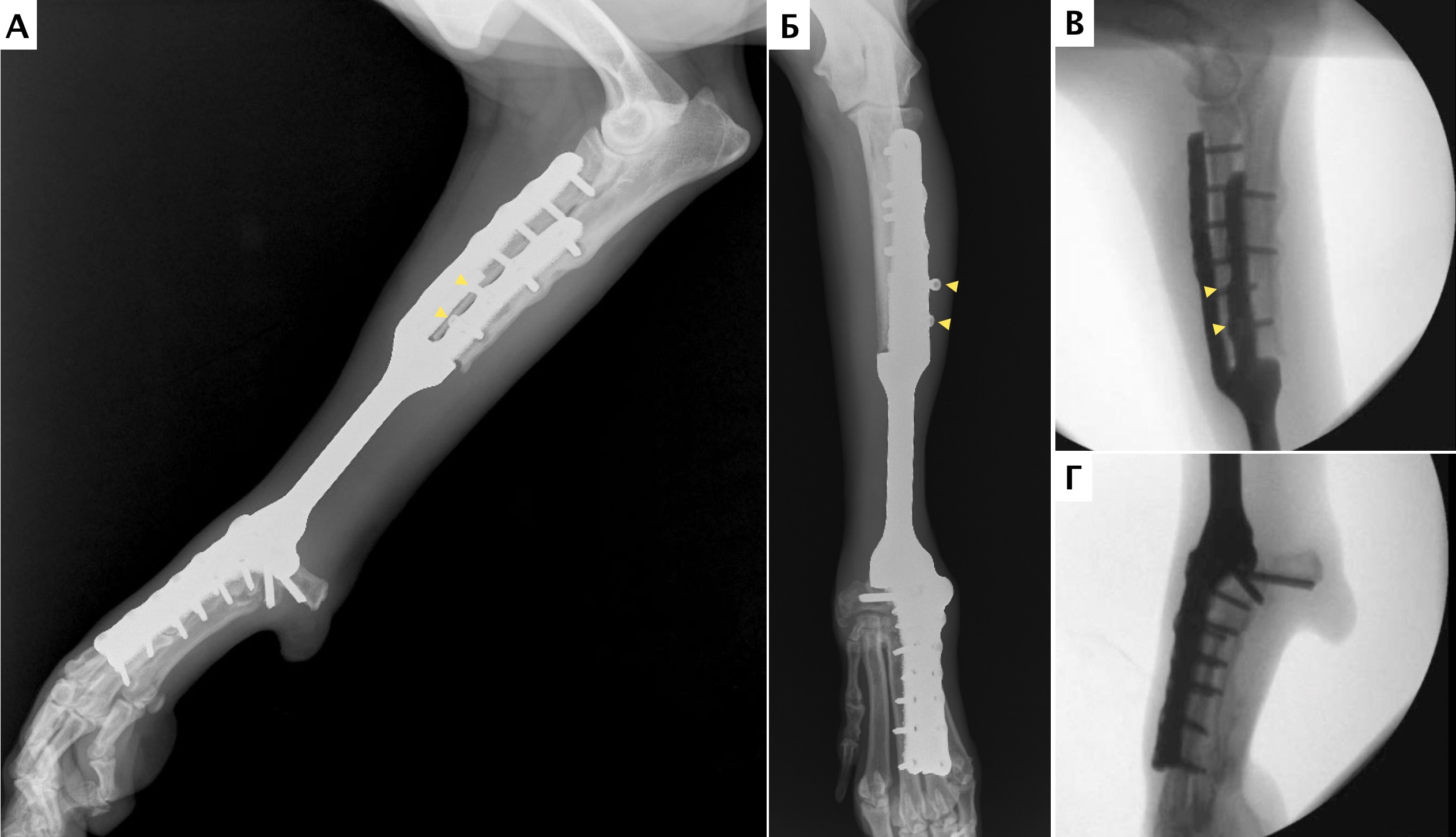
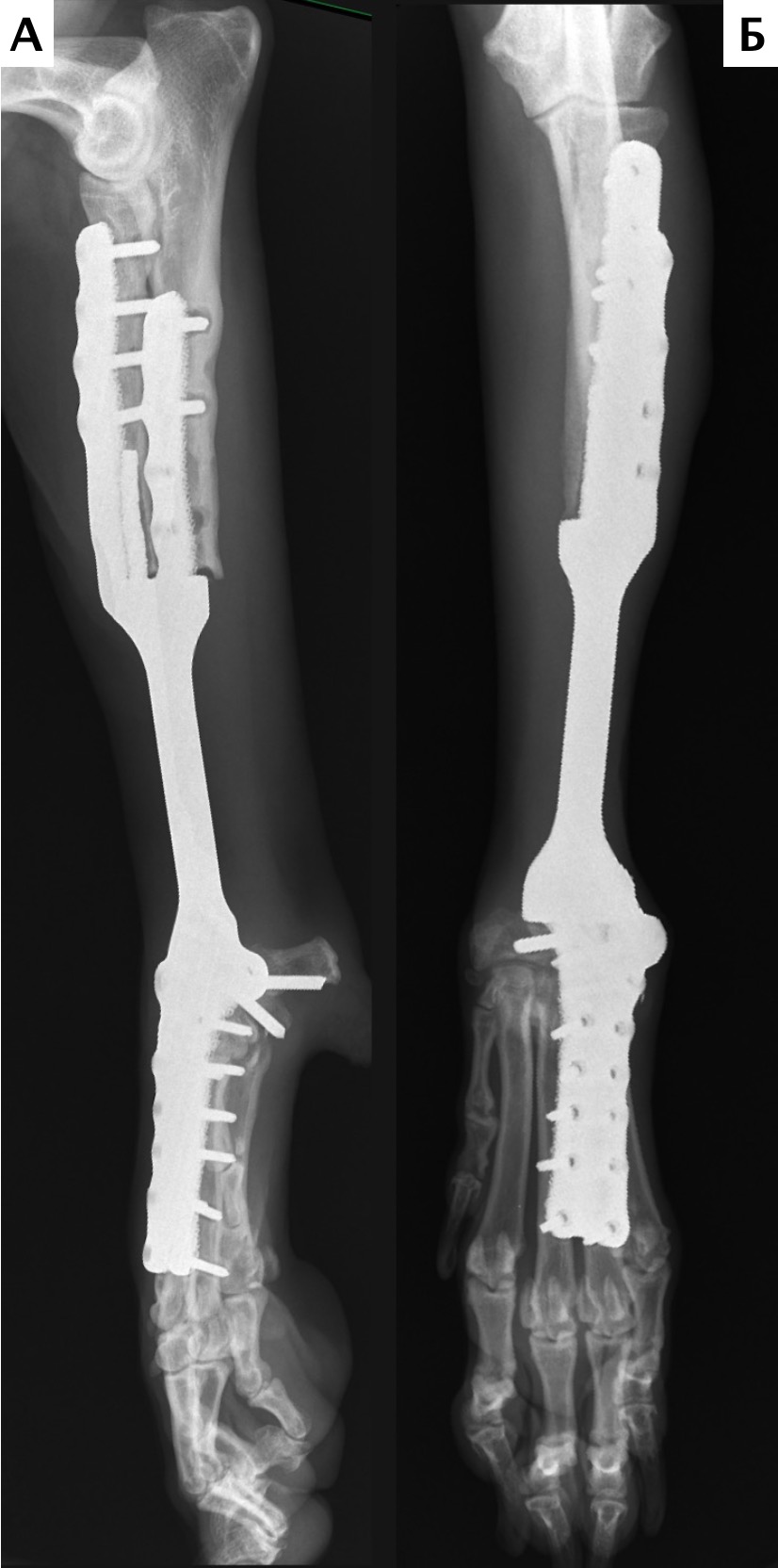
На втором этапе (реконструкция) выполняли фиксацию сегментов кости интрамедуллярными (ИМ) спицами Киршнера диаметром 2,0 мм, с последующей фиксацией LCP пластиной под блокируемые винты 4.5 мм с позиционированием пластины на краниальную поверхность лучевой кости и костей пясти с созданием полного артродеза запястного сустава (угол 10°). Реконструкцию костного дефекта выполняли с использованием костного цемента (ПММ) армированным ИМ спицами Киршнера. Также была выполнена дополнительная латеральная фиксация с использованием LC-DCP пластиной с винтами 3,5 мм (рис. 15). Операционную рану ушивали простыми узловыми швами атравматическим, адсорбирующим монофиламентным шовным материалом (моносорб). Послеоперационные рентгенограммы резецируемого сегмента были выполнены для оценки уровня резекции (рис. 16).
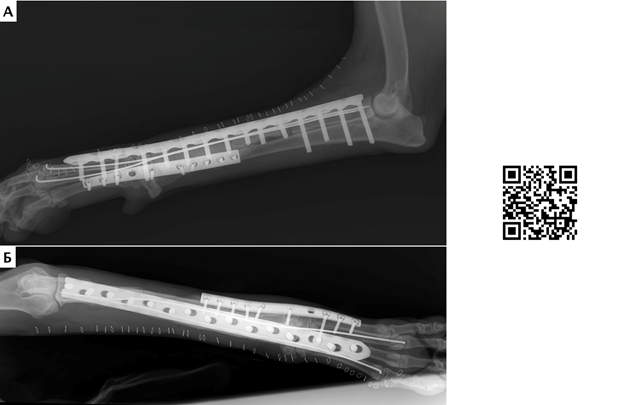
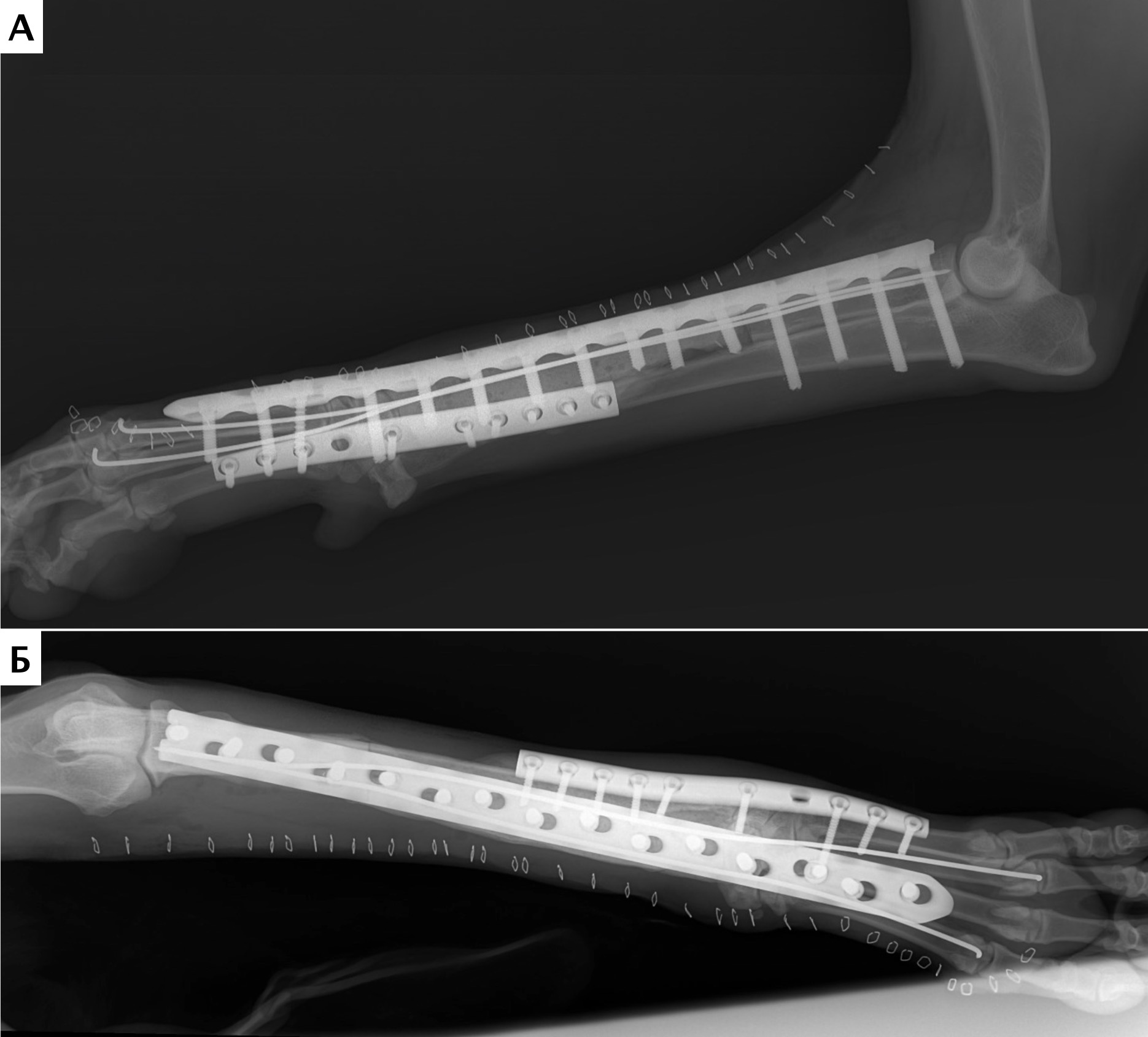
Рис. 16. Пациент №1. Контрольные послеоперационные рентгенограммы
Пациент №2
Локализация НО: диафизарный сегмент локтевой кости.
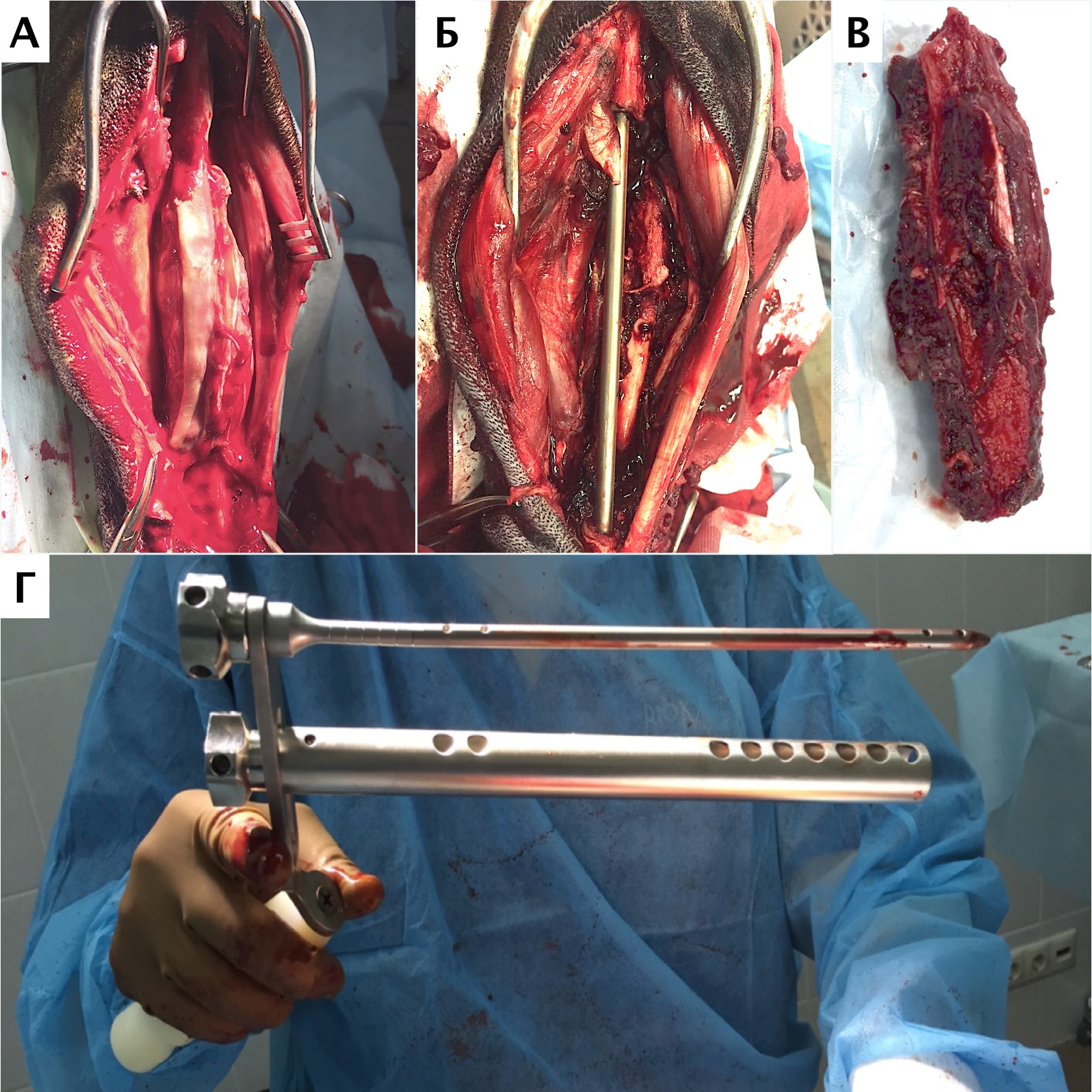
Первым этапом на основании данных КТ, предоперационно была выполнена оценка уровня резекции локтевой кости и подбор интрамедуллярного стержня системы БИОС по данным рентгенологического исследования контралатеральной конечности (рис. 17). Был выполнен каудолатеральный оперативный доступ от проксимальной части локтевой кости до уровня запястного сустава. Сегментарная резекция НО локтевой кости была выполнена единым блоком (en Block) с иссечением области проведения чрескожной КТ управляемой трепан-биопсии, с отступом 3,8 см от проксимальной границы НО от видимого очага остеодеструкции (рис. 18). На втором этапе путем ретроградного рассверливания выполняли формирование канала в проксимальном сегменте локтевой кости. Далее выполнялся монтаж системы БИОС, введение ИМ стержня в дистальный отломок локтевой кости с проксимальной и дистальной блокировкой ИМ стержня (рис. 19). Операционную рану ушивали простыми узловыми швами атравматическим, адсорбирующим монофиламентным шовным материалом (PDX). В послеоперационный период выполняли иммобилизирующую фиксацию с использованием повязки по типу Роберта-Джонса длительностью 5 суток.
А 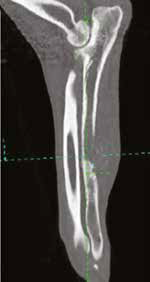 Б
Б 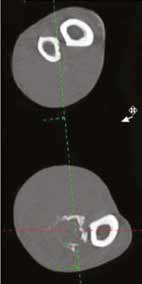 В
В 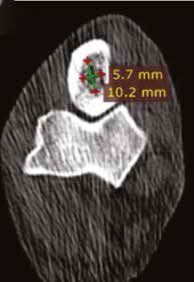 Г
Г 
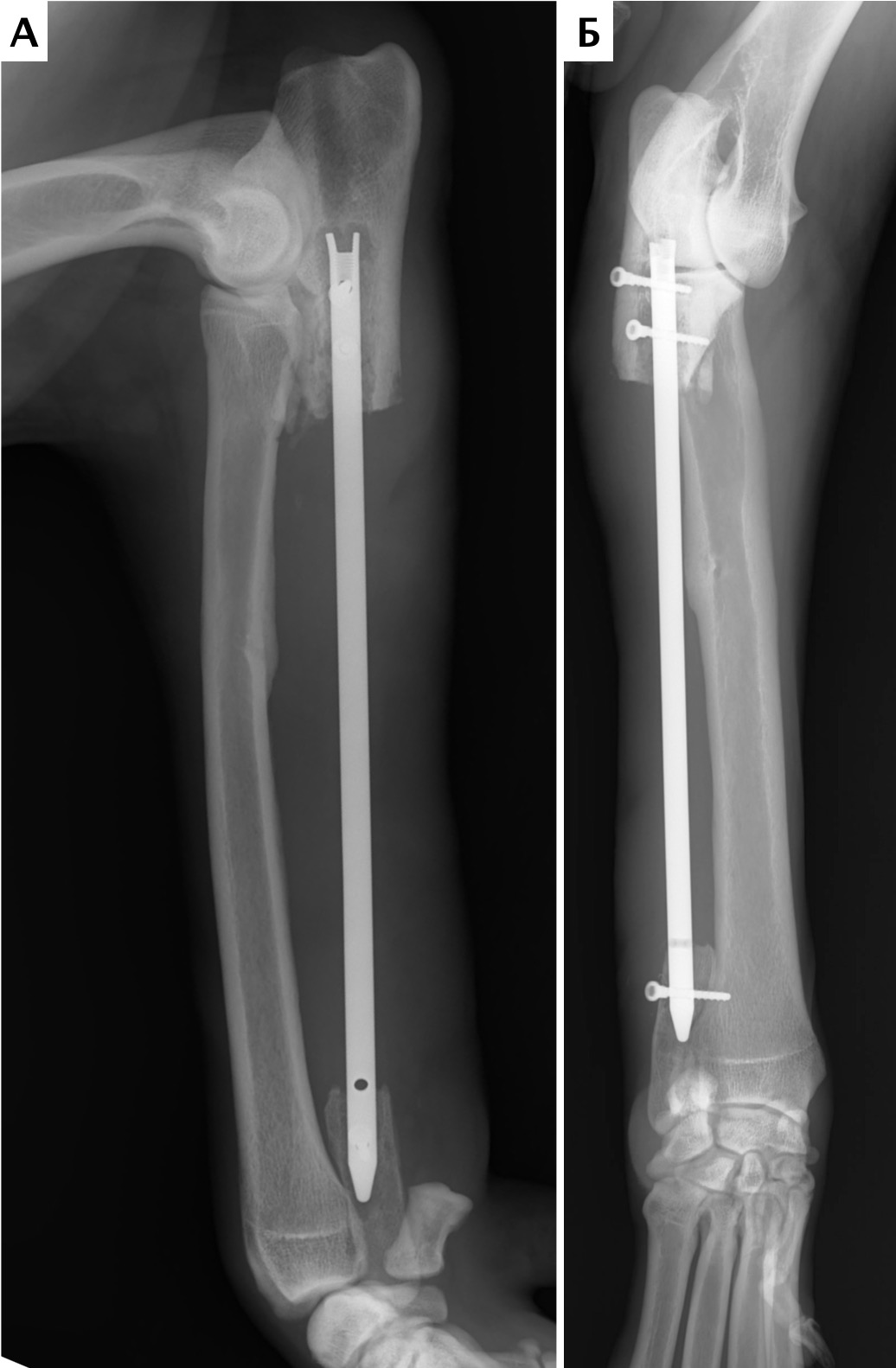
Рис. 17. Пациент №2. Сагитальный (А) и аксиальные (Б-Г) КТ-сканы. Предоперационное планирование уровня и объема резекции перед ОСО.
Выполняется отступ 4-5 см от границы остеодеструкции и подбор размера ИМ-стержня
А 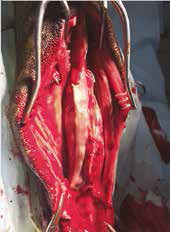 Б
Б 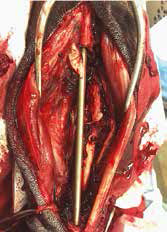 В
В  Г
Г 
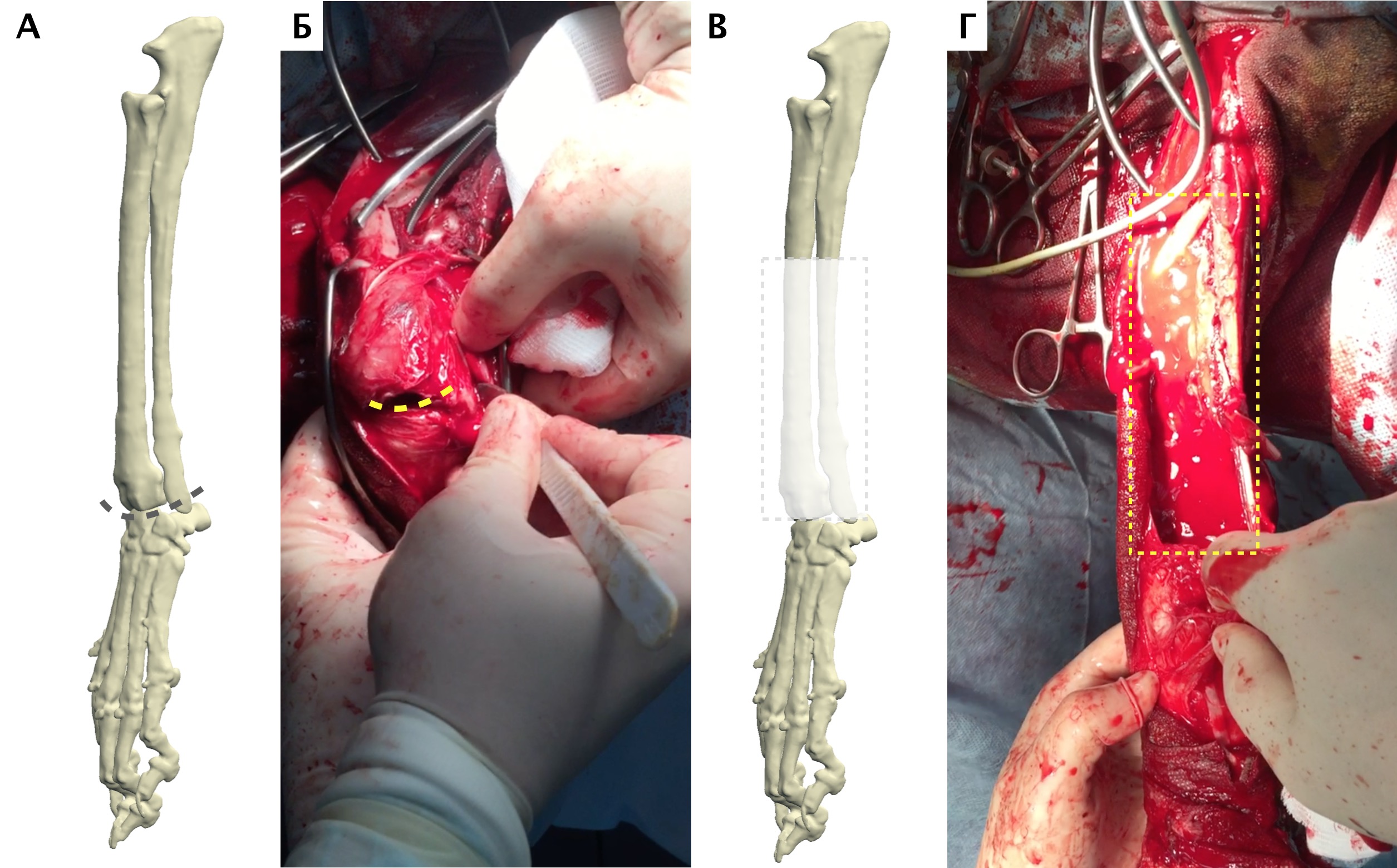
Рис. 18. Пациент №2. А – Оперативный доступ; Б – Резекция диафизарного сегмента
локтевой кости с последующей установкой блокируемого интрамедуллярного гвоздя;
В – Резецированный сегмент локтевой кости. Г – Система БИОС в сборке
А 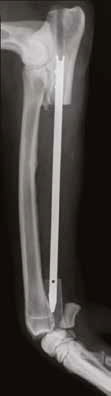 Б
Б 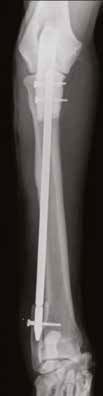

Рис. 19. Пациент №2. А, Б – Послеоперационные рентгенограммы (0 сутки). Выполнена интеркалярная резекция
диафизарного сегмента локтевой кости и БИОС
Пациент №3
Локализация поражения: дистальный сегмент лучевой кости. Для предоперационного планирования всех этапов оперативного лечения пациента №3 с разработкой модели и последующей 3D-печати эндопротеза и индивидуальных ПХН использовалось программное обеспечение Polygon Medical Engineering.
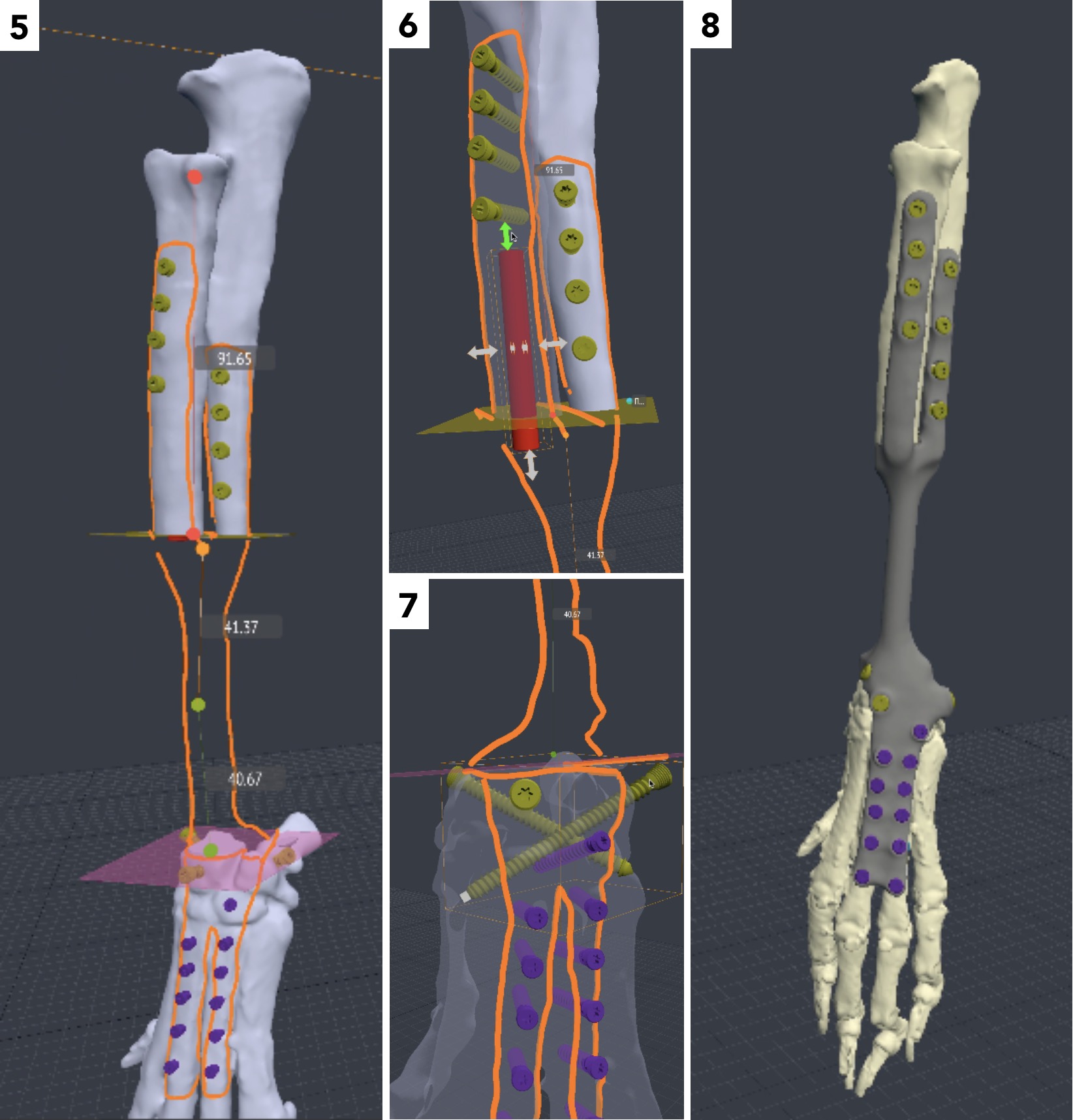
Алгоритм предоперационного планирования включал:
1. КТ грудных конечностей пациента с последующей загрузкой исходных данных (DICOM файлы) в программу планировщик Polygon (програмное обеспечение Polygon Medical Engineering). Дальнейшее планирование и редактирование 3D-модели выполняется непосредственно в программе-планировщике.
2. Сегментация костей конечности области интереса биоинженером (прим.: сегментация (segmentation) –выделение интересующих органов и их границ с последующей их визуализацией, анализом (измерение объема, площади поверхности или статистики распределения плотности в объекте) или с последующим экспортом в каком-либо виде (в виде полигональной модели).
3. Обозначение уровня резекции пораженного сегмента кости (опил кости) хирургом с последующим позиционированием конечности под требуемый угол с устранением ротации, сохранением длины и оси конечности (рис. 20).
1 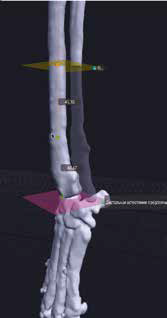 2
2 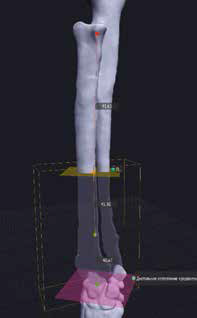 3
3 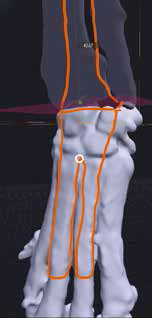 4
4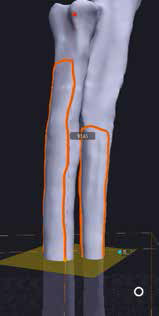
Рис. 20. Пациент №3. Планирование ОСО и разработка имплантатов и хирургических направителей в программе планировщике Polygon после
загрузки данных КТ. 1 – Разметка проксимальной и дистальной (2) линии остеотомии; 3,4 – Создание эскиза (отрисовка) требуемого имплантата
4. Создание эскиза требуемого индивидуального имплантата путем его «отрисовки» хирургом на поверхности кости, расстановка и выбор диаметра, длины и типа требуемых под имплантат винтов (рис. 21).
5 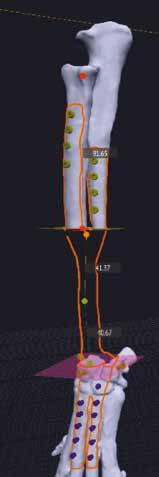 6
6  7
7 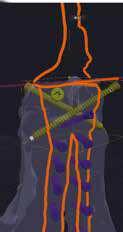 8
8 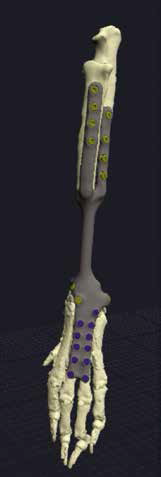
Рис. 21. Пациент №3. Планирование ОСО и разработка имплантатов и хирургических
направителей в программе планировщике Polygon после загрузки данных КТ. 1 – Разметка
проксимальной и дистальной (2) линии остеотомии; 3,4 – Создание эскиза (отрисовка)
требуемого имплантата
5. Создание и утверждение позиционных индивидуальных (персонифицированных) хирургических направителей (гайдов) (ПХН) для проксимальной и дистальной остеотомии (рис. 22).
А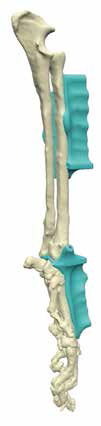 Б
Б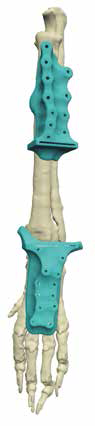 В
В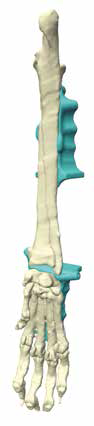
Рис. 22. Пациент №3. А-В – Разработанные позиционные
хирургические направители (гайды) для проксимальной
и дистальной остеотомии
6. Редактирование и утверждение проекта (рис. 23).
7. Изготовление индивидуального эндопротеза и персонифицированных ПХН для реконструкции костного дефекта методом аддитивного производства (рис. 24).
Используемый метод изготовления эндопротеза –выборочная лазерная плавка (SLM – Selective Laser Melting). Материал имплантата для замещения дефекта: титановый сплав (Ti6AI4V), класс металлообработки – 5.
Изготовленные методом 3D-печати ПХН использовались для проведения спланированного уровня и объема остеотомии на основании определенных хирургом предоперационно замеров и костных ориентиров.
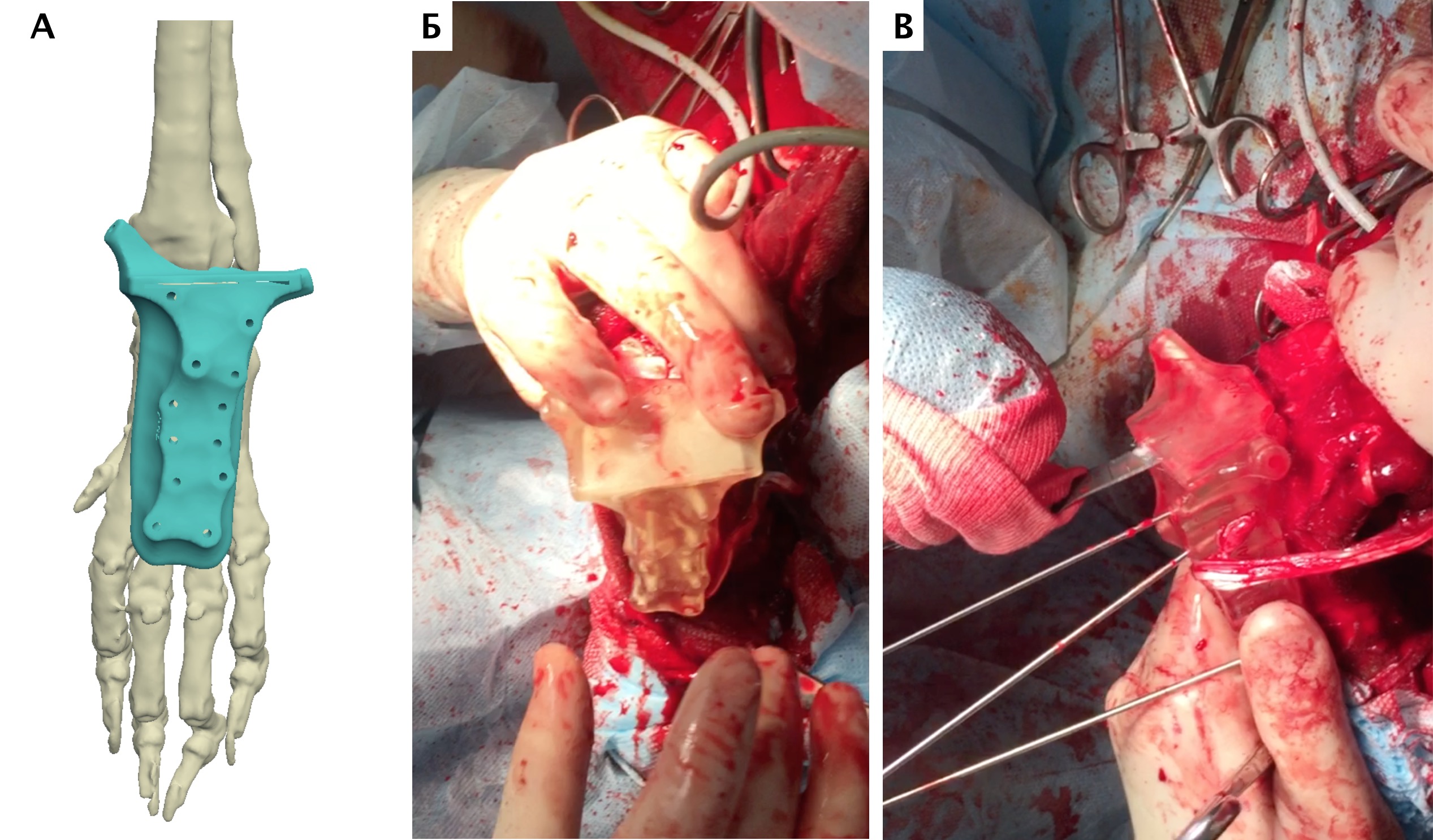
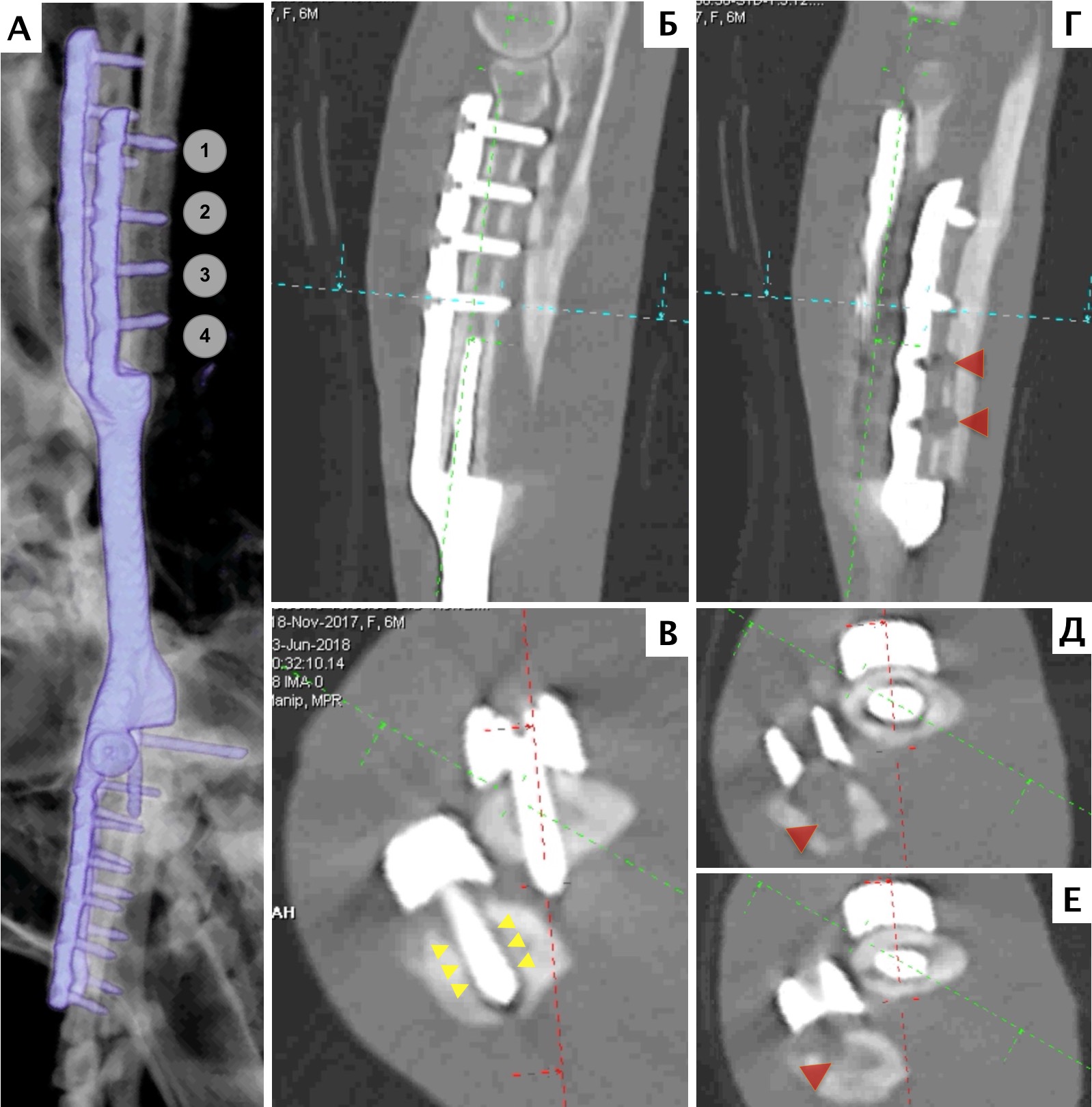
Основные интраоперационные этапы включали: краниолатеральный оперативный доступ с краниальной границей от локтевого сустава, до уровня III и IV пястных фаланг вдоль латеральной вены предплечья (рис. 25). Мыщцы супинатор и пронатор отводятся от проксимальной части лучевой кости. Лучевой нерв также требуется сохранять, выполняя его «защиту» на всем протяжении операции. Особое внимание уделяется сохранению кровоснабжения, особенно в дистальном сегменте в максимально возможной степени.
Далее выполняли установку проксимального ПХН. Требуется выполнять точное позиционирование ПХН на кости, с последующей его фиксацией транскортикальными спицами Киршнера. После проксимальной остеотомии локтевой и лучевой костей через паз ПХН, выполняли скелетирование резецированного сегмента кости до уровня запястного сустава. На дистальном уровне выполняли поперечную артротомию с установкой ПХН на поверхность суставного хряща запястной лучевой и локтевой костей (рис. 26, 27).
Далее была выполнена широкая сегментарная резекция пораженной кости в мышечно-фасциальном футляре без вскрытия псевдокапсулы (en Block). Далее выполняли введение проксимального ИМ компонента эндопротеза и последовательное введение блокируемых винтов с фиксацией эндопротеза. Перед «посадкой» ИМ компонента, была выполнена предварительная обработка ИМ канала лучевой кости (римирование) (рис. 28).
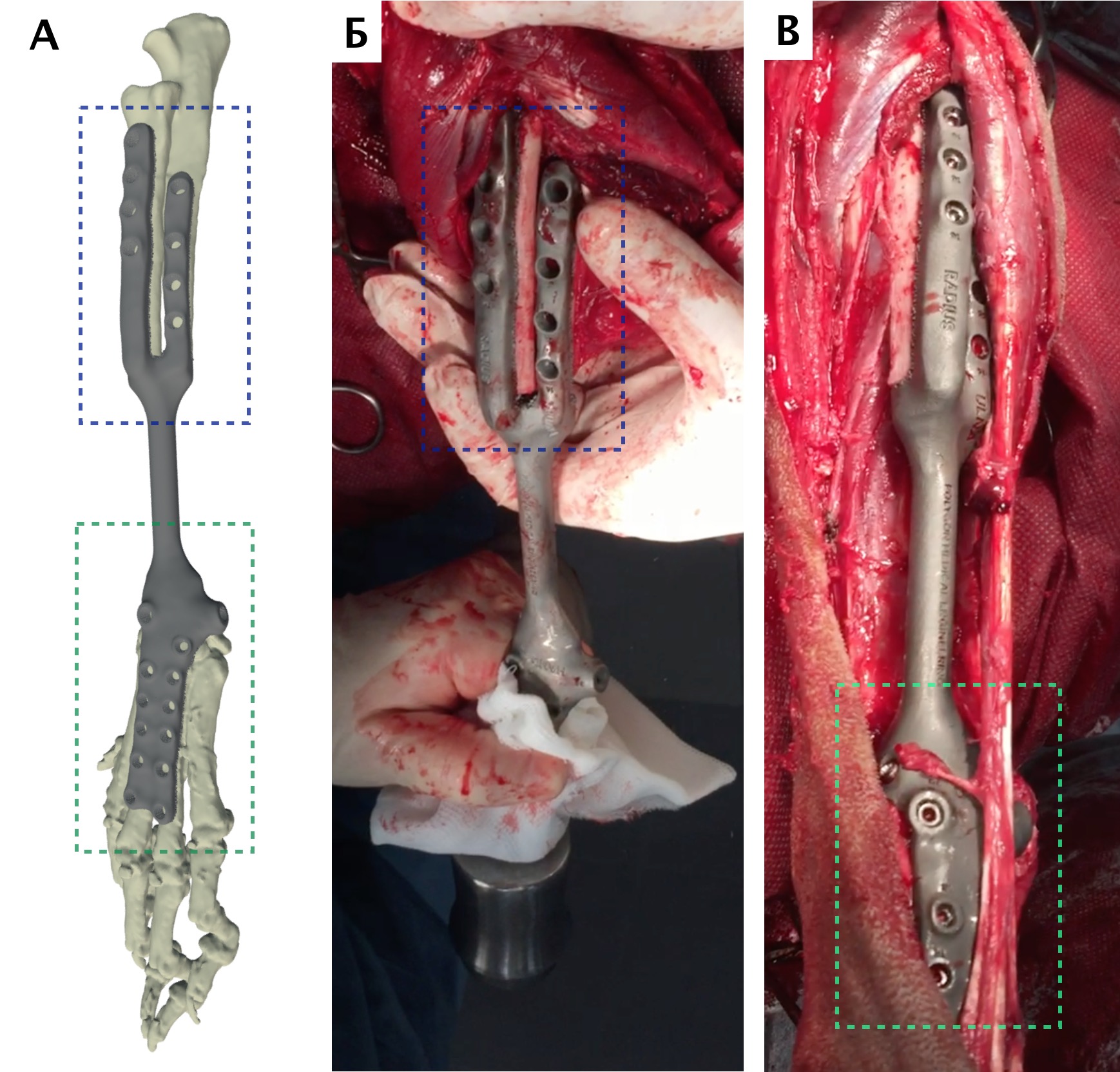
Разработанная конфигурация эндопротеза имеет следующие характеристики: в проксимальной части для крепления к сегментам кости эндопротез имеет экстрамедуллярный компонент, представленный двумя пластинами на лучевую и локтевую кости под угол-стабильные винты 3.5 мм и интрамедуллярный компонент в виде пористого ИМ стержня, фиксируемый в проксимальную часть лучевой кости методом «плотной посадки» (press-fit).
В дистальной части эндопротез также имеет экстрамедуллярный компонент в виде двух пластин для фиксации на кости пясти (3 и 4) под угол-стабильные винты 2,7 мм. Центральная часть эндопротеза, соединяющая дистальный и проксимальный конец эндопротеза имеет форму цилиндра. Все области контакта эндопротеза с костью на прокисмальном и дистальном участке имеют пористую (трабекулярную) структуру для достижения остеоинтеграции (прорастание кости в пористую структуру эндопротеза).
Операционную рану ушивали простыми узловыми швами атравматическим, адсорбирующим монофиламентным шовным материалом (PDX). Послеоперационно выполняли контрольные рентгенограммы, а также рентгенограммы резецируемого сегмента кости для предварительной оценки границ резекции (рис. 29).
Послеоперационный период
В послеоперационном периоде у одного пациента (№1) использовали повязку Роберта-Джонса сроком до 3-х дней. Послеоперационная противовоспалительная терапия включала в себя применение препарата фирококсиб (Previсox) в дозировке 5 мг/кг, 1 раз в день курс на 14 дней. В послеоперационный период на протяжении 14 дней использовали антибактериальные препараты: синулокс (12,5 мг/кг, 2 р/д). Курс 21 день (№1), 14 дней (№2), 21 день (№3). Адьювантная химиотерапия выполнялась во всех случаях от 4-х до 6 курсов препаратом карбоплатин, 300 мг/м2, однократно. Далее 1 раз в 3 недели с интервалом не более 21 суток. Пациент №1 (6 курсов), №2 (4 курса), №3 (выполнено 5 курсов; терапия продолжается до настоящего времени на момент написания работы).
Результаты
Основные сравнительные характеристики и результаты по длительности наблюдения, степени хромоты, хирургической технике у представленных пациентов представлены в табл. 2. Опорная функция конечности присутствовала с первых суток у пациентов №2 и №3 после оперативного вмешательства. У пациента №1 восстановление функциональной опороспособности отмечалось на 24 сутки. Заживление операционной раны у всех животных произошло по первичному типу натяжения. Предоперационные показатели ЩФ у всех пациентов отмечались в пределах нормы. Стоит отметить, что по некоторым данным повышение ЩФ отмечается только в 28% из исследования 45 собак с ОС (Mitchell, 2015).
Костный дефект в % от общей длины пораженной кости составлял: №1 (63%; 13 см, от 20,6 см), №2 (52,69%; 13,7 см, от 26 см), №3 (54,44%; 9,2 см, от 16,9 см).
Безрецидивный период составлял: №1 (238 дней; 7 мес., 25 дней,), №2 (345 дней; 11 мес.11 дней), №3 (87 дней до настоящего момента).
|
Таблица 2. Основные параметры для оценки пациентов с аппендикулярной ОС до и после ОСО |
||||||||||||||
|
Пациент / Порода |
Возраст (годы)/вес |
Диагноз/стадия |
Степень хромоты до ОСХ |
Локализация опухоли / Гистологический диагноз |
Техника ОСО и РпРКД |
Величина резецированного сегмента |
Степень хромоты после ОСХ (через 2 мес.) |
Осложнения |
Безрецидивный период (сутки)/Продолжительность жизни с момента постановки диагноза (сутки) |
||||
|
№1 метис |
10 лет, 54 кг |
ОС/IIb стадия T2N0M0 |
5 |
Дистальный сегмент лучевой кости |
Интраартикулярная СР+РпРКД армированным КЦП с формированием полного артродеза запястья |
13,3 см. |
3 |
Миграция винта LC-DCP пластины локтевой кости, местный рецидив ОС, инфицирование, метастазирование в позвоночный столб |
238/586 |
|||||
|
№2 кане-корсо |
8 лет, 47 кг |
ОС/IIb стадия T2N0M0 |
4 |
Диафизарный сегмент локтевой кости |
Интеркалярная СР+РпРКД БИОС |
13,7 см. |
2 |
- |
-/345 |
|||||
|
№3 родезийский риджбек |
2 года, 35 кг |
ОС/IIb стадия T2N0M0 |
5 |
Дистальный сегмент лучевой кости / остеосаркома, продуктивная, степень I |
Интраартикулярная СР+РпРКД иЭП с формированием полного артродеза запястья |
9,2 см. |
1 |
Миграция винта из иЭП сегмента локтевой кости |
-/96+До настоящего времени |
|||||
|
Сокращения |
ОС – остеогенная саркома; СР – сегментарная резекция; РпРКД – реконструкция пострезекционного костного дефекта; аКЦП – армированный костно-цементный протез; иЭП – индивидуальный эндопротез |
|||||||||||||
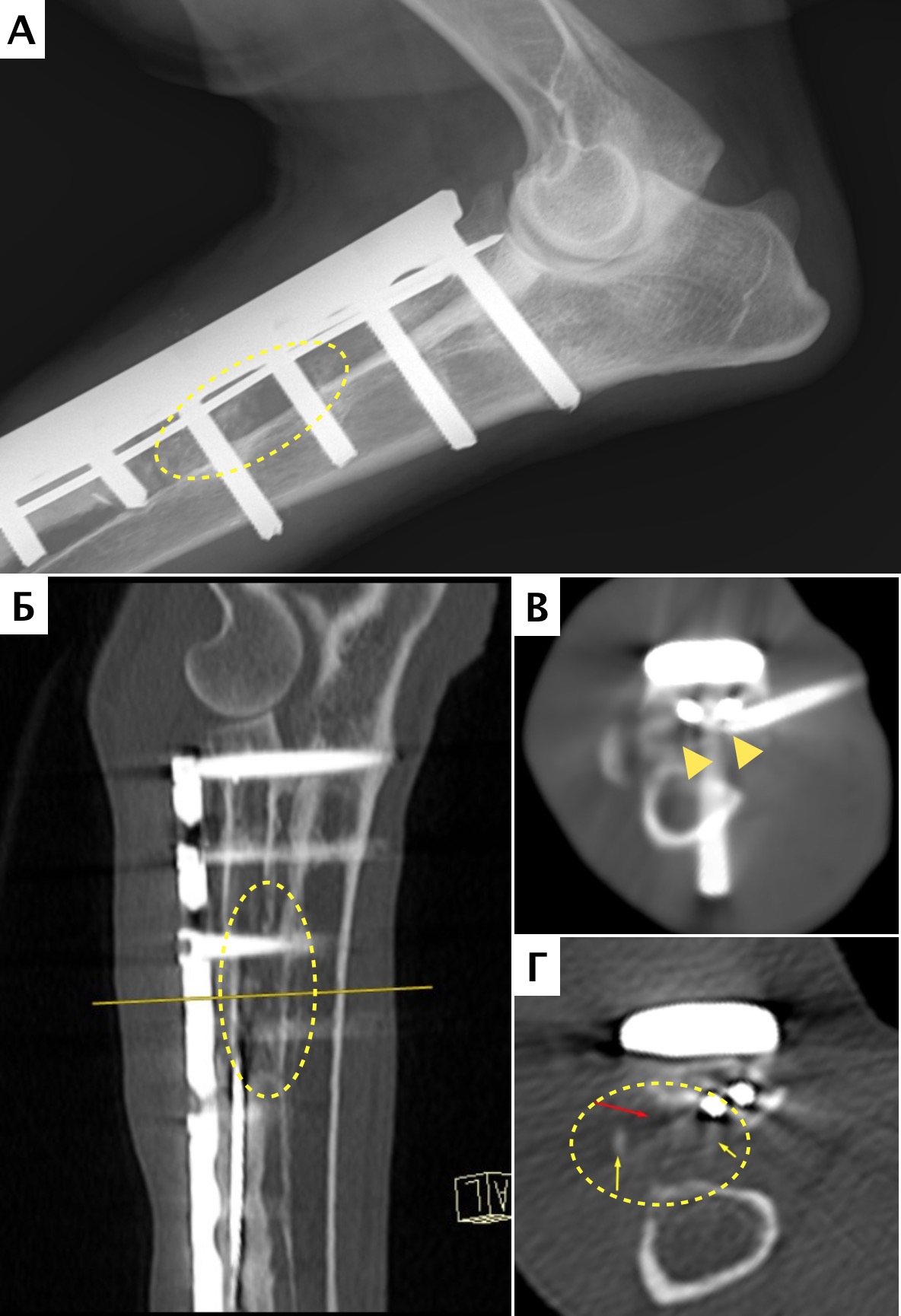
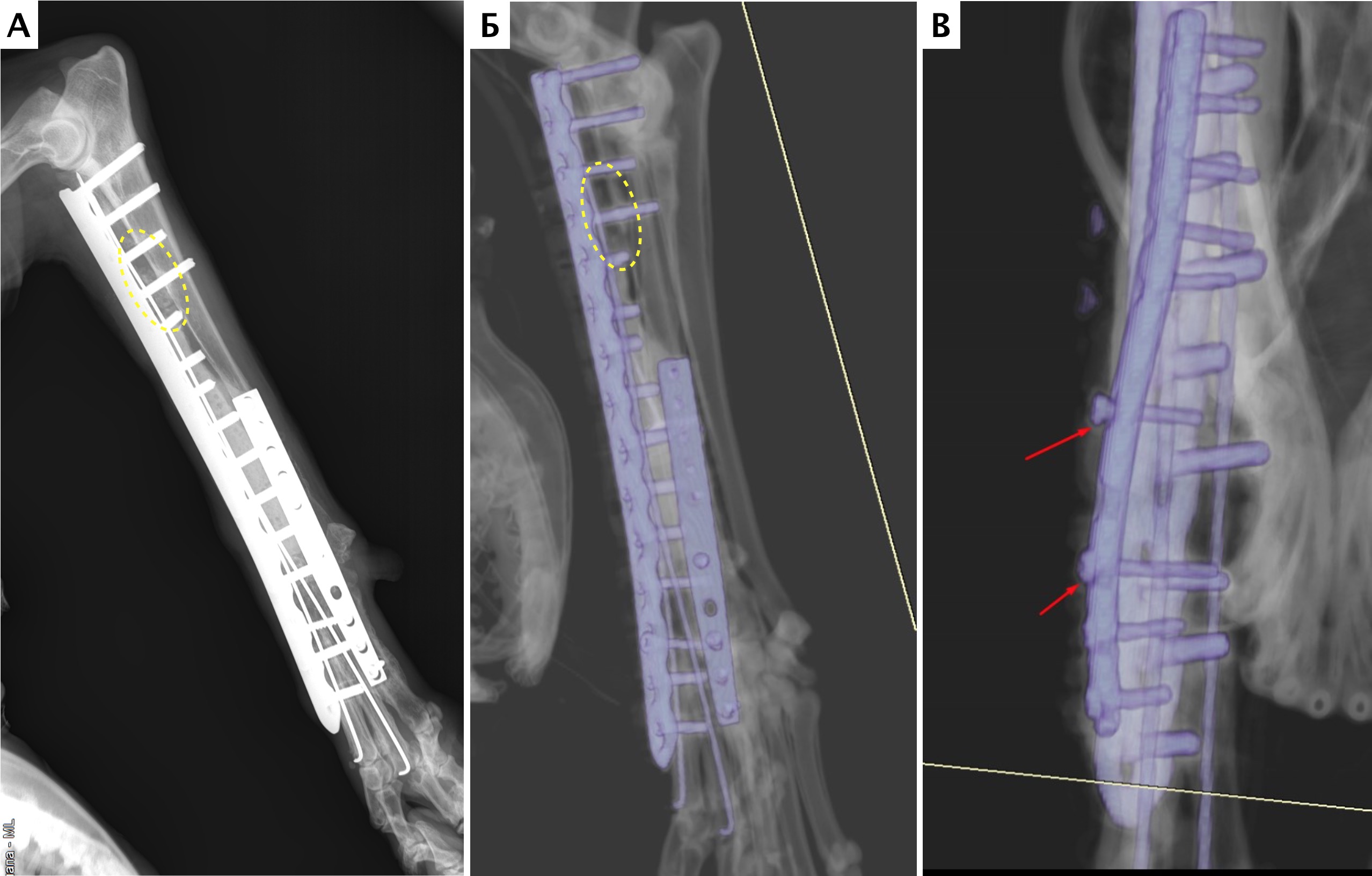
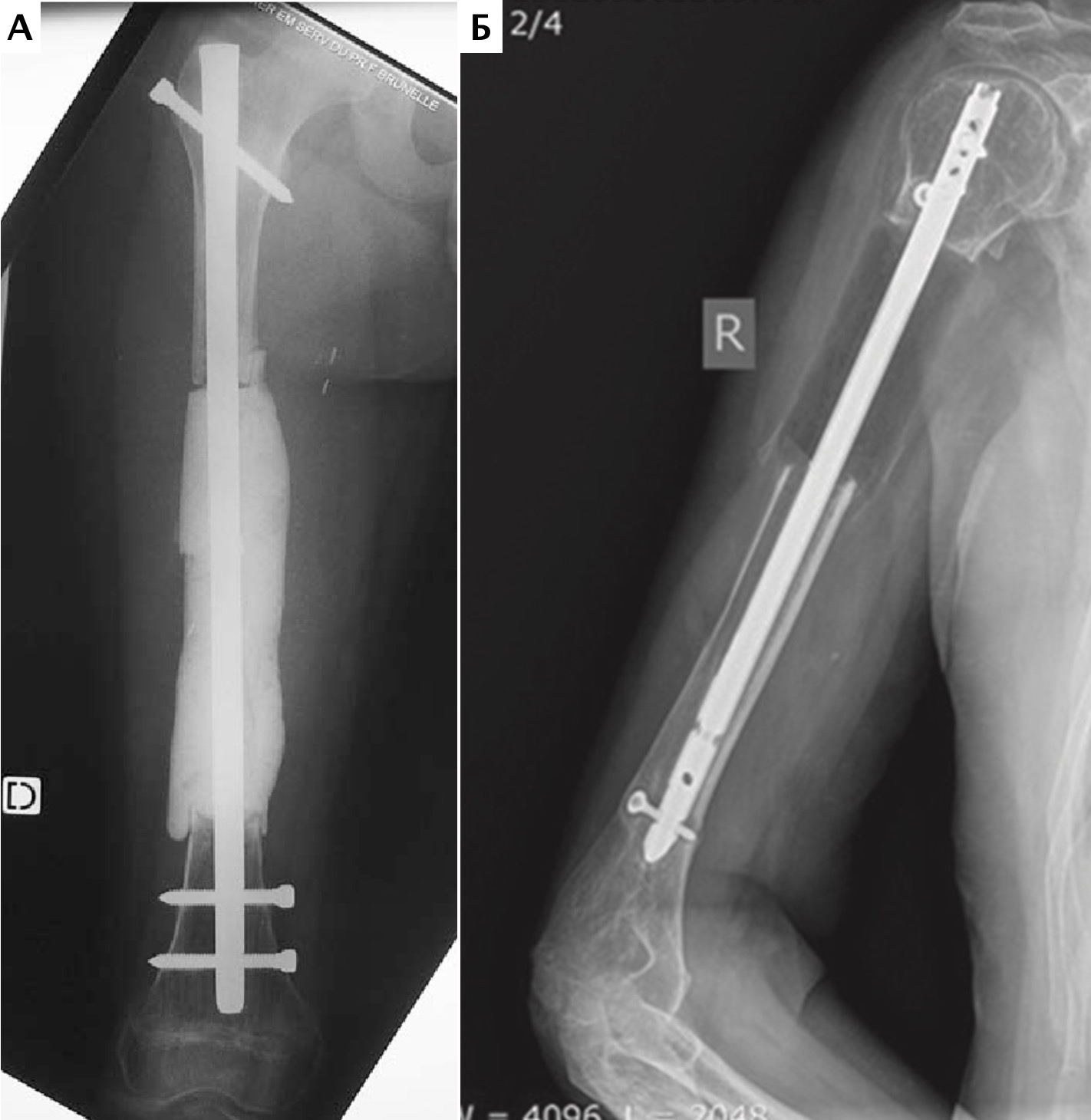
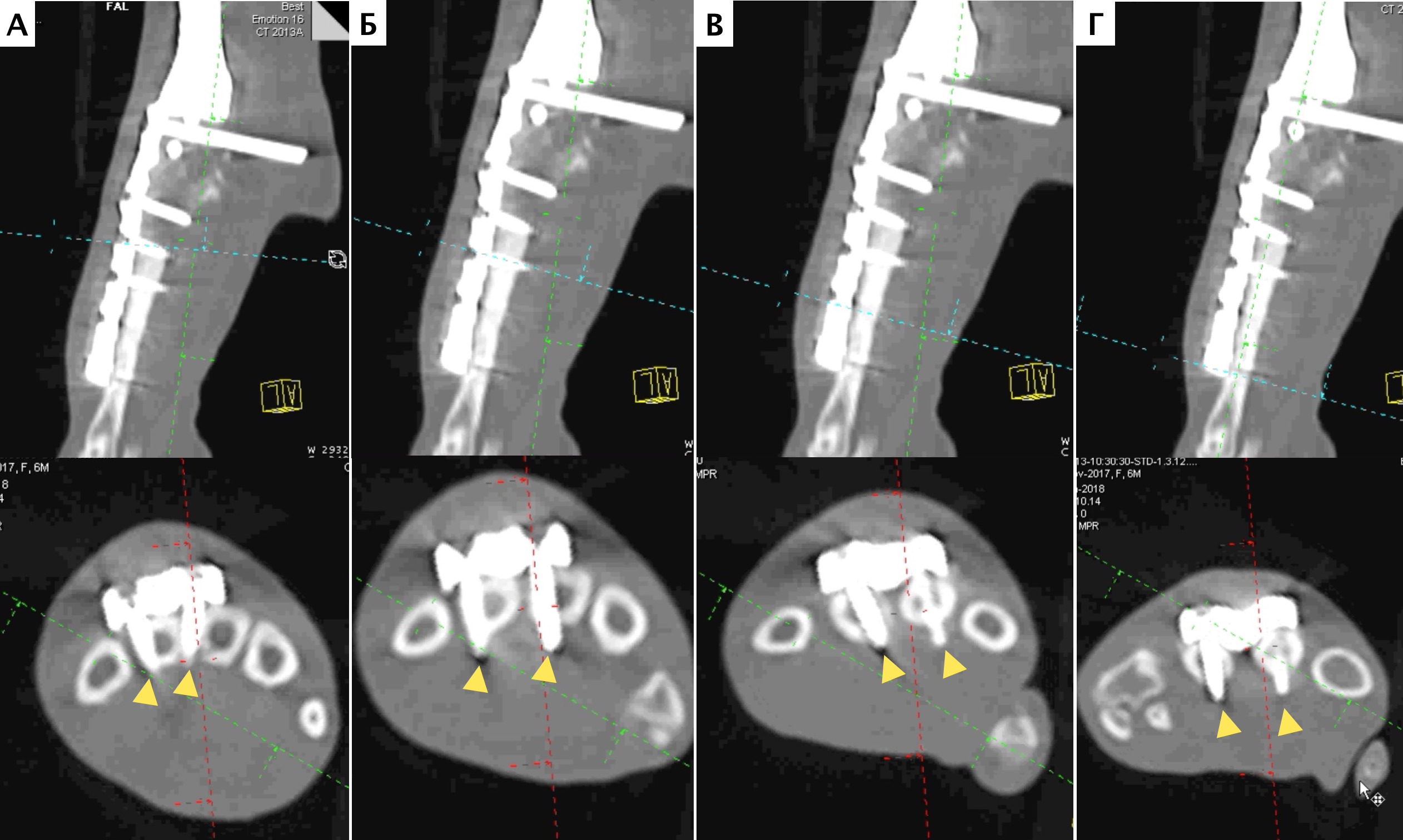
Местное рецидивирование было отмечено на основании данных рентгенограмм в одном случае (пациент №1) в области проксимальной части лучевой кости через 7 месяцев с последующим подтверждением методом КТ управляемой чрескожной трепанобиопсии (рис. 30, 31).
Пациенту была выполнена высокая (тотальная) ампутация грудной конечности со скапулэктомией.
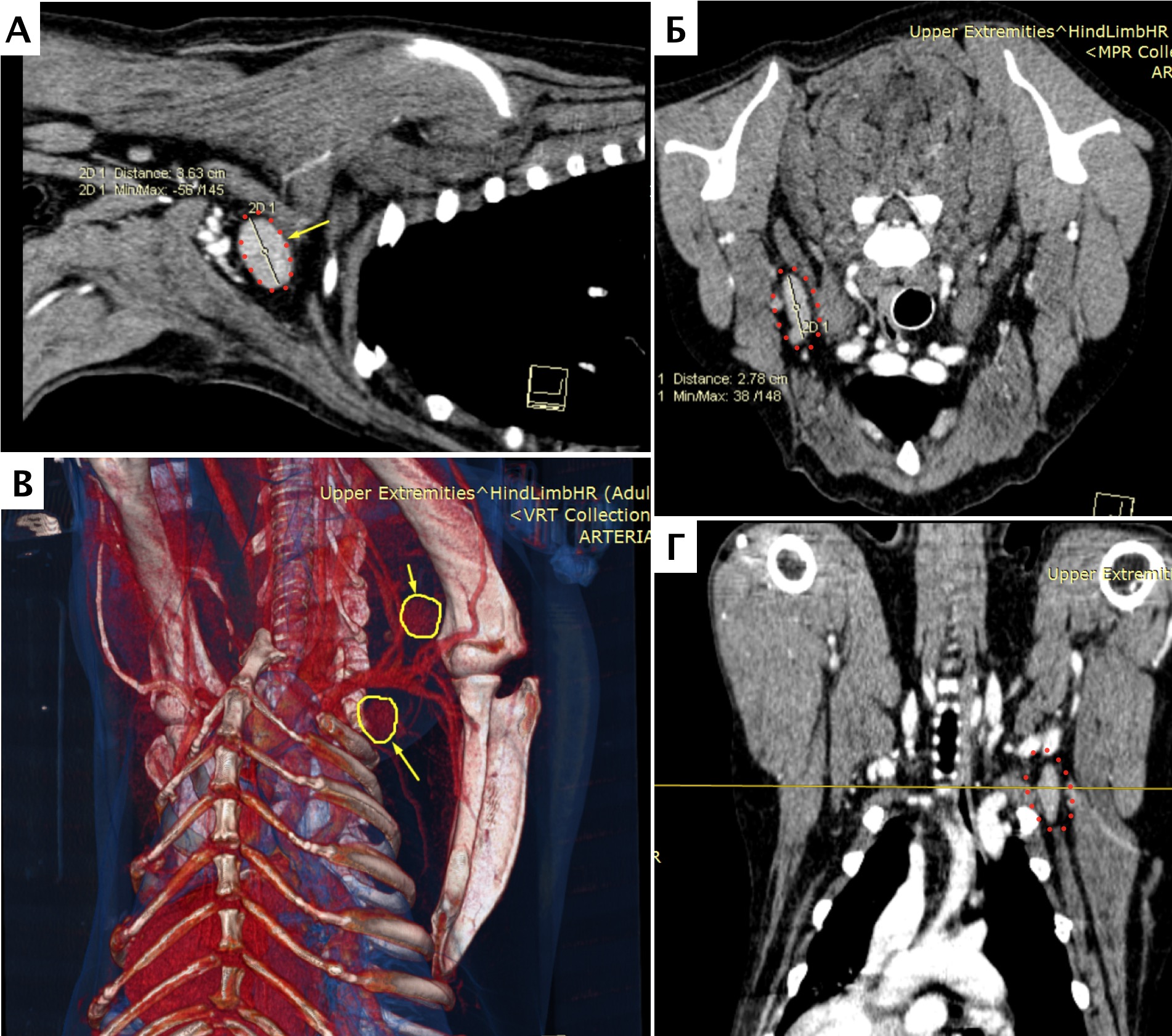
Метастатическое поражение было отмечено в одном случае (пациент №1) через 580 дней с момента постановки диагноза (274 дней после ампутациии). Появились жалобы, со стороны владельцев на слабость при вставании, активном движении у пациента. По результатам КТ-онкопоиска в динамике было выявлено остеолитическое поражение с выраженной пролиферацией костной ткани тела С2 шейного позвонка, а также новообразование селезенки с генетрогенным накоплением контраста (рис. 32). Повторного гистологического исследования выявленных поражений не проводилось. Пациент был эвтаназирован по желанию владельцев.
Продолжительность жизни с момента постановки диагноза составляла:
№1: 586 дней; 19 месяцев, 8 дней;
№2: 345 дней; 11 месяцев11 дней;
№3: 96 дня до настоящего времени на момент написания работы.
Один пациент (№3) на момент написания работы жив. Пациент №2 погиб остро во время прогулки без клинических симптомов ухудшения общего состояния. Результаты гистологического исследования пациентов представлены на (рис. 33).
Анализ и оценка осложнений. Клинические рекомендации
Основные осложнения после выполнения ОСХ по литературным данным включают: инфицирование, местный рецидив, несостоятельность фиксации, метастатическое поражение (Withrow& Vail, 2007). Также отмечены такие осложнения, как: выраженный болевой синдром, длительная хромота, временная нейропраксия и стойкий неврологический дефицит с потерей чувствительности [27].
На основании всего периода наблюдения нами были выявлены следующие осложнения: скопление серомы в области реконструируемого дефекта (n=3), миграция винтов в двух случаях (n =2), формирование свищевого хода в одном случае. Выявленные осложнения по временной градации рассматривали в ближайший (1-7 суток), ранний (7-14-21 суток) и отдаленный (3-4 недели) послеоперационные периоды.
Для структуризации осложнений использовали классификацию Henderson (2010 г.), используемую после первичного эндопротезирования, включающую 2 группы: механические и немеханические осложнения. Механические осложнения включают: I тип – осложнения, связанные с мягкими тканями (вывих, контрактура, нейропатия); II тип –
асептическая нестабильность (клинические и рентгенографические признаки нестабильности); III тип –
структурные осложнения эндопротеза (перелом эндопротеза, перелом кости, перипротезный перелом). Немеханические осложнения включают: IV тип – инфекционные осложнения; V тип – местный рецидив. Нами были отмечены осложнения I, II, IV и V типов.
На сегодняшний день развитие послеоперационной инфекции является наиболее частым и серьезным осложнением, которое развивается в 30-75% случаев в первые 6 месяцев после проведения ОСХ (LaRueetal. 1989;Dernell et al. 1998).
Несостоятельность имплантов отмечают в 40% случев, однако значимая потеря случается лишь в 10% (Liptak et al., 2006).
Местный рецидив опухоли наблюдается в 20-28% случаев (Morello et al., 2001; Withrow et al., 2004; Liptak et al., 2006).
Инфицирование и лимфоцеле
Инфицирование может варьировать от легкой раневой инфекции до тяжелого остеомиелита. Известно, что развитие послеоперационной инфекции в виде вялотекущего воспаления связано с меньшей частотой местного рецидивирования ОС и с увеличением средней продолжительности жизни и временем выживания в сравнении с теми пациентами, у кого не происходит инфицирования. Связь между инфекцией и лучшим исходом у данных пациентов, на сегодня не до конца ясна, но считается, что она связана с воспалением и развитием иммунологических реакций (Liptak).
Инфекция чаще встречается после заживления хирургической раны и после прекращения курса антибактериальной терапии (обычно через 4 недели после окончания курса химиотерапии) [9]. Около 33% инфекций встречаются <6 месяцев и 67% встречаются ≥ 6 месяцев после операции [9].
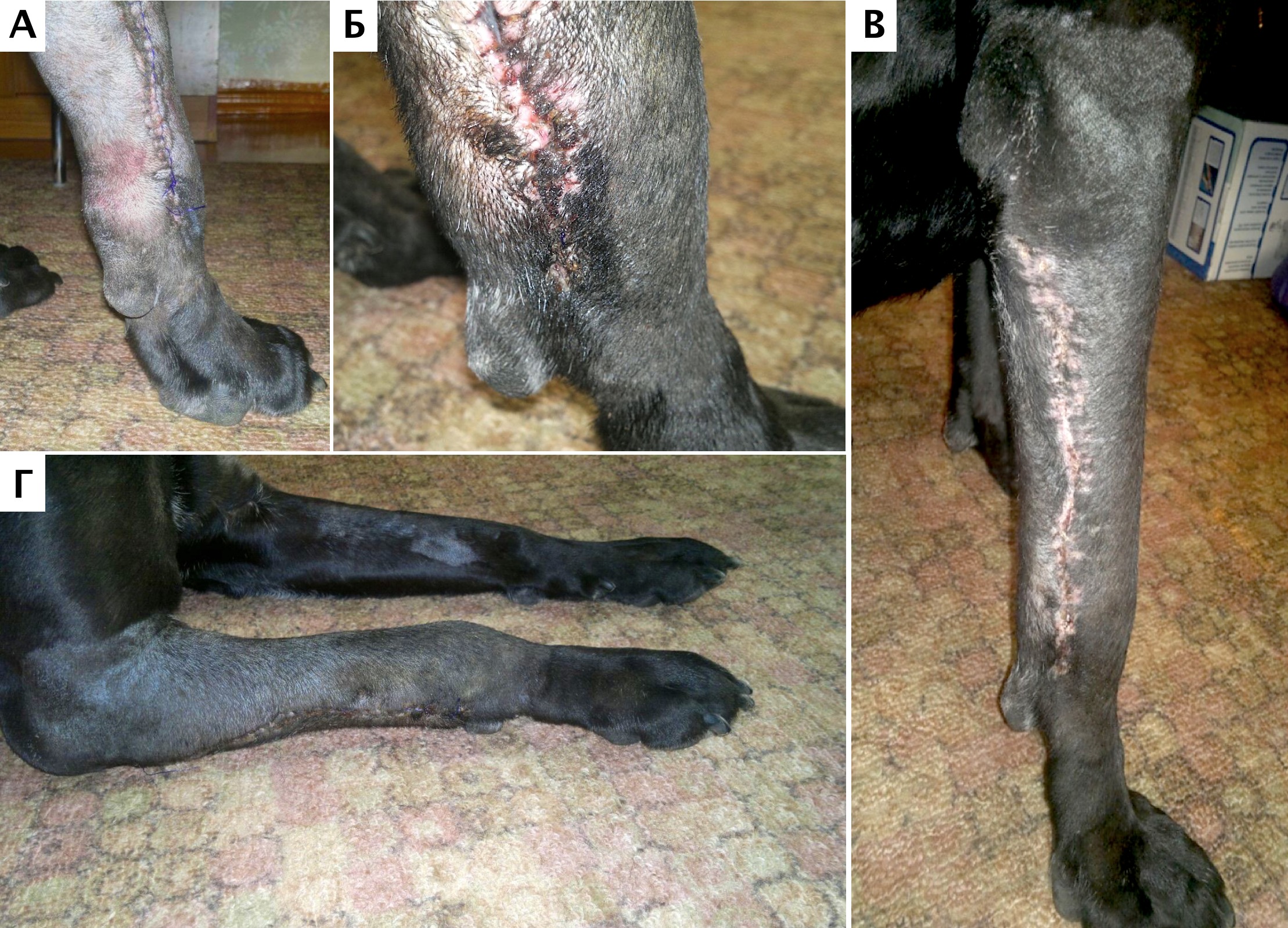
К общим осложнениям относится развитие серомы (прим.: лимфоцеле; длительная серозная экссудация) отмечавшееся во всех случаях в ближайший п/о период (рис. 34). Длительность сохранения отделяемого отмечалось: №1 (25 дней), №2 (7 дней), №3 (20 дней). Предполагается, что серома не является осложнением, а представляет собой нормальный процесс течения заживления раны, который соответствует фазе экссудации раневого воспаления [36, 37]. Таким образом, формирование серомы не относится к «истинным» инфекционным осложнениям, которые можно было бы интерпретировать в качестве прогностической оценки более длительного выживания. Развитие серомы в большинстве случаев связано с неизбежным формированием «мертвого» пространства после ОСХ ввиду обширной резекция пораженной кости и мягких тканей. По данным ряда исследователей, основными причинами образования сером являются: наличие раневой полости и реакция организма на имплант, контакт эндопротеза с подкожно-жировой клетчаткой, обширная диссекция и мобилизация подкожно-жировой клетчатки а также использование электрокоагуляции [36, 37]. Серома служит питательной средой для патологической флоры, что может привести к последующему инфицированию. В рандомизированных исследованиях показано, что использование электрокоагулятора во время операции повышает риск образования сером по сравнению с обычным скальпелем. Использование ультразвуковых ножниц для выполнения лимфодиссекции приводит к снижению образования сером [37].
При формировании серомы у пациентов было выполнено: 3-х кратная аспирация содержимого с интервалом 4-5 дней (пациент №1). Во втором случае (пациент №2) выполнялась однократная аспирация и наложение повязки по типу Роберта-Джонса на 5 дней. Стоит отметить, что по ряду исследований гуманной медицины компрессионный трикотаж позволяет уменьшить объем послеоперационной полости [36, 38]. Отмечено, что расположение в сформированной полости после обширной резекции НО фибрин-коллагенового препарата (коллагеновая гемостатичсая губка) может быть эффективно в качестве интраоперационной меры для профилактики сером без последующего дренирования зоны хирургического вмешательства [36].
В другом случае (пациент №3) выполнялось удаление дистального шва и «сливания» серомы с последующим наложением асептической повязки со сменой раз в сутки до прекращение выделений. Период антибактериальной терапии был продолжен до полного прекращения выделений. Стоит отметить, что аспирация может увеличивать частоту развития осложнения в виде инфицирования имплантата [27]. Применение вакуумной дренажной системы с отрицательным давлением может профилактировать или купировать данное осложнение в случае его развития, однако само дренажное устройство и его длительное нахождение в полости, по ряду данных, может повышать вероятность инфицирования [38]. На основании анализа литературных данных [27] и наблюдений авторов, у пациентов группы риска и особенно в случаях развития инфицирования после ОСХ (свищевые ходы), пролонгированная антибиотикотерапия курсами или с «пожизненным» курсом может быть оправдана и не иметь значимых побочных эффектов.
Окончание в следующем номере
Литература
1. Трофимцов, Д., Вилковыский, И., Аверин, М. и др. Онкология мелких домашних животных. Учебное пособие . б.м. : Издательство: Научная библиотека, 2017.
2. Outcomes of Limb-Sparing Surgery Using Two Generations of Metal Endoprosthesis in 45 Dogs With Distal Radial Osteosarcoma. A Veterinary Society of Surgical Oncology Retrospective Study. Katherine E. Mitchell, Sarah E. Boston, Marvin Kung, Sarah Dry, Rod C. Straw, Nicole P. Ehrhart, and Stewart D. Ryan. 2016 г., Veterinary Surgery 45 (2016) 36–43.
3. Dernell, WS, Ehrhart, NP, Straw RC, et al: 2007.
4. Kudnig, S.T., Séguin, B. Veterinary surgical oncology. 2015.
5. Ground reaction force analysis of large breed dogs when walking after amputation of a limb. . Kirpensteijn, J, Van Den Bos, R, Van Den Brom WE,et al:. 2000 г., Vet Rec 2000;146:155–159 .
6. Tobias, K., Johnston, A. Veterinary surgery: small animal; Volume Set 2. . б.м. : by Saunders, an imprint of Elsevier Inc, 2012 .
7. Terracini, B, Glickman. LT. 1998 : б.н. Vet J 156:31.
8. Textbook of Small Animal Surgery (3rd ed). Slatter, D.H.
9. Veterinary Society of Surgical Oncology, 2015.
10. Cooley, DM, Beranek, BC, Schlittler, DL, et al,. 2002.
11. Transplantation of ipsilateral canine ulna as a vascularized bone graft for treatment of distal radial osteosarcoma .Zlatinov, V. 2018. February 13, 2018.
12. Методология выполнения органосохраняющих операций в комплексном лечении опухолей костей конечностей у собак и кошек. П.Г. Дюльгер, С.А. Ягников, Ф.А. Любоев, О.А. Кулешова, М.Д. Валюс, Я.А. Кулешова, Т.А. Леонова. 2016 г., Российский ветеринарный журнал.
13. Histologic Grade Does Not Predict Outcome in Dogs with Appendicular Osteosarcoma Receiving the Standard of Care. Schott, C. R., Tatiersky, L. J., Foster, R. A., Wood, G.A. 2017 г., Veterinary Pathology. Reprints and permission: sagepub.com/journalsPermissions.nav DOI: 10.1177/0300985817747329 journals.sagepub.com/home/vet.
14. Imaging Osteosarcoma. Ali Nawaz Khan, Durr-e-Sabih, Klaus L. Irion, Hamdan AL-Jahdali and Koteyar Shyam Sunder Radha Krishna. 2012 г. ISBN: 978-953-51-0506-0, InTech.
15. Accuracy of computed tomography in determining lesion size in canine appendicular osteosarcoma . Ketaki s. Karnik, Samii, V.F. Weisbrode, S.E, London,C.A., Green, E.M. 2012 г., Veterinary Radiology & Ultrasound, Vol. 00, No. 00, 2012, pp 1–6.
16. Fossum, T.W.,. Small Animal Surgery. б.м. St Louis: Mosby; 2012. pg. 1254–1276. Т. 3rd ed.
17. Остеогенная саркома у детей . В.Б.Силков, Т.Д.Викторович, М.Б.Белогурова В.Б.Силков: e-mail silkucci@mail.ru. Ноябрь 2002 г. г., Биомедицинский журнал, Medline.ru , Т. ТОМ 3, стр. 34 (стр. 266).
18. Results of surgery and doxorubicin chemotherapy in dogs with osteosarcoma. . Berg, J, Weinstein, MJ, Springfield, DS, et al. 1995 г., JAVMA206:1555-1560, 1995. .
19. Canine Osteosarcoma: A Naturally Occurring Disease to Inform Pediatric Oncology. Fenger, Joelle M., Cheryl, A. London, William, C. Kisseberth ILAR. [ред.] Published: 01 April 2014. 2014 г., Journal, Volume 55, Issue 1, 1 January 2014, стр. Pages 69–85, https://doi.org/10.1093/ilar/ilu009.
20. Adjuvant therapy for osteosarcoma in dogs: results of randomized clinical trials using combined liposome-encapsulated muramyl tripeptide and cisplatin. Kurzman, I.D, MacEwen, E.G, Rosenthal, R.C, Fox LE, Keller ET, Helfand SC, Vail DM, Dubielzig RR, Madewell BR, Rodriguez CO Jr, et al. 1995 г., Clin Cancer Res. 1995 Dec;1(12):1595-601.
21. Практические рекомендации по лечению первичных злокачественных опухолей костей (остеосаркомы, саркомы Юинга). Феденко А.А., Бохян А.Ю., Горбунова В.А., Махсон А.Н., Тепляков В.В. 2017 г., Рекомендации восточно-европейской группы по изучению сарком: Практические рекомендации RUSSCO #3s2, 2017 (том 7). С. 203–215.
22. Клинические рекомендации по диагностике и лечению больных с первичными злокачественными опухолями кости. Алиев М.Д. Бохян А.Ю., Иванов С.М., Соколовский В.А., Соколовский А.В., Феденко А.А. 2014. Общероссийский союз общественных объединений. Ассоциация онкологов России.
23. Intraosseous transcutaneous amputation prosthesis (ITAP) for limb salvage in 4 dogs.; . Fitzpatrick N, Smith TJ, Pendegrass CJ, Yeadon R, Ring M, Goodship AE, Blunn GW. 2011 г., Vet Surg. 2011 Dec;40(8):909-25. . doi: 10.1111/j.1532-950X.2011.00891.x. Epub 2011 Nov..
24. A system for the surgical staging of musculoskeletal sarcoma. Enneking, W.F., Spanier, S.S., Goodman, M.A. 1980 г., Clin. Orthop. –1980.-Vol.153.-P.106-120.
25. The staging and surgery of musculoskeletal neoplasms.Enneking, WF., Wolf, RE,. 1996 г., OrthopClin N Am 1996;27(3):473-81.):
26. Massive bone loss around the knee - the orthopaedic oncological perspective . Hosking, K. 2012 г., Print version ISSN 1681-150XSA orthop. j. vol.11 n.4 Centurion Jan. 2012.
27. D. Griffon, A,Hamaide. Complications in Small Animal Surgery . [ред.] ISBN: 978-0-470-95962-6. б.м. : Wiley-Blackwell , Jan 2016.
28. Методология выполнения органосохраняющих операций в комплексном лечении опухолей костей конечностей у собак и кошек. П.Г.Дюльгер, С.А.Ягников, Ф.А.Любоев, О.А.Кулешова, М.Д.Валюс, Я.А.Кулешова, Т.А.Леонова. б.н., 2012 г., РВЖ, No 3/2012.
29. Практические рекомендации по диагностике и лечению остеосаркомы у детей подростков. Сенжапова, Э.Р., Дзампаев, А.З., Хестанов, Д.Б. б.м. : НИИ ДОиГ ФГБНУ «РОНЦ им. Н.Н.Блохина , 23.04.2015. http://www.pediatriconcology.ru/helpers/news/1268/.
30. Cortical bone graft and endoprosthesis in the distal radius of dogs: a biomechanical comparison of two different limb-sparing techniques. Liptak JM, Ehrhart N, Santoni BG, et al. Vet Surg 2006;35:150–160.
31. Cortical allograft and endoprosthesis for limb-sparing surgery in dogs with distal radial osteosarcoma: a prospective clinical comparison of two different limb-sparing techniques. . Liptak JM, Dernell WS, Ehrhart N, et al. 2006 г., Vet Surg 2006;35:518–533.
32. Tumors of the skeletal system, in withrow sj, macewen eg (eds): Small Animal Clinical Oncology. Dernell, WS, straw, RC, withrow, SJ. б.м.Philadelphia, WB SAUNDERS, 2001, PP 378-417., 2001 г.
33. Outcomes of Limb-Sparing Surgery Using Two Generations of Metal Endoprosthesis in 45 Dogs With Distal Radial Osteosarcoma. A Veterinary Society of Surgical Oncology Retrospective Study . Mitchell, K.E., Boston, S.E., Kung, М, Dry, S., Straw, R.C. 2015 г., Veterinary Surgery 45 (2016) 36–43 .
34. Limb salvage surgery for osteosarcoma of the proximal humerus: outcome in 17 dogs. . Kuntz, C.A, Asselin, TL, Dernell, WS, Powers, BE, Straw, RC, Withrow, SJ. 1998 г., Vet Surg. 1998 Sep-Oct;27(5):417-22. .
35. Cortical bone graft and endoprosthesis in the distal radius of dogs: a biomechanical comparison of two different limb-sparing techniques. Liptak, JM, Ehrhart, N, Santoni, BG, et al. б.м. : Vet Surg 2006;35:150–160 .
36. Серомы как осложнение хирургического лечения послеоперационных грыж передней брюшной стенки с использованием сетчатых имплантов: современное состояние проблемы. Деговцов, Е.Н., Колядко, П.В. 2018 г., Новости хирургии Том 26 * № 1 * 2018. doi: 10.18484/2305-0047.2018.1.96.
37. Lumachi, F. Seroma prevention following axillary dissection in patients with breast cancer by using ultrasound scissors: a prospective clinical study. Lumachi, A.A. Brandes, P. Burelli et al. 2004 г., Eur. J. Surg. Oncol. — 2004. — 30. — P. 526-30.
38. Клинический случай лечения длительной лимфорреи, возникшей после радикальной мастэктомии. Ивашков, В.Ю. Соболевский, В.А. 2015 г., Поволжский онкологический вестник.
39. Novel Endoprosthesis for Limb Sparing of Canine Distal Radius Osteosarcoma Patients: A Modular Approach. Shetye, S., Ryan,S., Ehrhart, N., Puttlitz, C. Colorado State University : б.н., 2011. DOI: 10.1115/SBC2011-53164 .
40. Novel modular limb salvage endoprostheses for treatment of primary appendicular tumors in dogs: short-term outcome. Fitzpatrick, J. Meswania, G. Blunn. Bologna (Italy) : WVOC 2010, 15th - 18th September, 568 N, 2010.
41. Хирургическое лечение пациентов с опухолями длинных трубчатых костей верхних конечностей с использованием индивидуальных имплантатов из костнозамещающего материала, созданных по технологиям 3D-печати . Н.Н. Карякин, Р.О. Горбатов, А.Е. Новиков, Р.М. Нифтуллаев. б.м. : Том 23, No 3, 2017 г., 2017 г., Журнал клинической и экспериментальной ортопедии им. Г.А. Илизарова.
42. Биомеханические параметры имплантатов при замещении обширных дефектов кости у собак . Дюльгер, П.Г. Ягников, С.А. Гаврюшенко, Н.С. Фомин, Л.В. Кулешова, О.А. Арифуллина Д.В. 2012 г., РВЖ • МДЖ • No 5/2012 .
43. Аутопластика костного дефекта большеберцовой кости при первичном эндопротезировании коленного сустава. Баитов, В.С., Гуражев, М.Б., Прохоренко, В.М. 2017 г., Современные проблемы науки и образования. – 2017. – № 6.
44. Компьютерная технология изготовления медицинских имплантатов методом послойного лазерного спекания . М.М. Тверской, Л.Н. Петрова, А.С. Аладин, Е.Ю. Сулацкая, А.С. Жаринова. Вестник ЮУрГУ, No 23, 2012.
45. Hammer, AS, Weeren, FR, Dickerson, ME, Page, RL,. 2005.






Назад в раздел


















