Хирургическое лечение аппендикулярной остеосаркомы у собак на основании трех клинических случаев. Выбор метода при замещении пострезекционных костных дефектов
Автор (ы): С.С. Горшков (gorschkov.vet@gmail.com), Н.В. Уланова (vet.best@mail.ru), Е.М. Козлов, В.В. Мануйлова, Е.И. Петрова
Организация(и): Ветеринарная клиника «Бэст» (Новосибирск)
Журнал: №5 - 2018
Отчаянные болезни требуют отчаянных средств
Hippocrates
УДК 619:617.3:616-77
Окончание (начало www.vetpharma.org)
Ключевые слова: мелкие домашние животные, органосохранные операции, остеосаркома, 3D-печать, индивидуальные хирургические позиционные направители (гайды)
Key words: mall pets, organ-preserving surgeries, osteosarcoma, 3-dimensional, individual surgical positioners
Сокращения:
НО – новообразования; ОС — остеогенная саркома (остеосаркома); ОСО – органосохранная операция; LCP — locking compression plate (блокирующаяся компрессионная пластина);
LС-DCP (Limited Contact Dynamic Compression Plate) – динамическая компрессионная пластина ограниченного контакта; БИОС - блокируемый интрамедуллярный остеосинтез;
МРТ — магнитно-резонансная томография; КТ – компьютерная томография; НПВС — нестероидные противовоспалительные средства;
ОМЖ – опухоль молочной железы; ПКК – плоскоклеточная карцинома; ОГЭ – овариогистерэктомия; МТ – метастазы (метастатические поражения);
аКЦО – армированный костно-цементный остеосинтез; аКЦП – армированный костно-цементный протез (эндопротез); ПММА – полиметилметакрилат (костный цемент);
3D (от англ.: 3-dimensional – трехмерная модель, 3D-моделирование, 3D-печать, 3D-печать металлом) – общее название технологий аддитивного производства металлических изделий;
SLS (Selective Laser Sintering) – выборочное лазерное спекание; SLM (Selective Laser Melting) – выборочная лазерная плавка; FDM (Fused Deposition Modeling) – моделирование методом послойного наплавления;
ABS-пластик – акрилонитрилбутадиенстирол (АБС); DICOM-файл (DICOM File) – медицинский отраслевой стандарт создания, хранения, передачи и визуализации цифровых медицинских изображений и документов обследованных пациентов;
ПХН – позиционный хирургический направитель (синоним: хирургический направляющий шаблон (гайд); в литературе также упоминается как прецизионный персонифицированный (индивидуальный) направитель (ППН).
ПЭТ или ПЭТ/КТ – позитронная эмиссионная томография
Аннотация
В данной статье представлены 3 хирургические техники по реконструкции пострезекционных костных дефеков (пРКД) после органосохранных операций (ОСО) при аппендикулярной остеосаркоме на основании 3-х клинических случаев. Рассмотрены особенности хирургических техник с реконструкцией пРКД костным цементом (ПММ) армированным интрамедуллярными спицами Киршнера (армированный костно-цементный остеосинтез – аКЦО) с последующей фиксацией сегментов кости LCP+LC-DCP пластинами; техника реконструкции пРКД с использованием индивидуального эндопротеза, изготовленного методом 3D-печати с использованием аддитивных технологий и техника реконструкции с использованием системы БИОС. Представлены особенности выполняемых хирургических техник и клинические рекомендации с оценкой преимуществ, недостатков и осложнений данных методов.
Несостоятельность фиксации (НФ)
Несостоятельность фиксации в виде перелома, миграции имплантов отмечают в 40% случаев. Однако тяжелые осложнения, требующие ревизионной хирургии с заменой имплантата встречаются лишь в 10% (Liptak et al. 2006 a) Основные причины НФ включают в себя сочетание биологических и механических факторов, которые могут привести к ослаблению фиксации с последующим развитием миграции и/или перелома имплантатов в послеоперационный период.
Механические факторы НФ включают [Mitchell, 2015]: несоответствующий размер имплантата (короткие конструкции) и его тип (не подходящий для ОСХ имплантат); циклические нагрузки на имплантаты, эндопротез.
К биологическим факторам относятся: инфицирование в результате иммуносупрессии, вызванной опухолью или самим лечением (хирургическое лечение и применение химиотерапии); предоперационная лучевая терапия; пациенты с сопутствующими заболеваниями (ожирение, наличии ранее имеющегося очага инфекции, эндокринопатии, неврологические или ортопедические патологии контралатеральных конечностей).
Реоперация или удаление имплантата при НФ требуется не во всех случаях, а лишь при клинической картине и доказательствах нестабильности имплантата. В случаях же с миграцией винтов может быть выполнено лишь их удаление без полной ревизии.
Таблица 1. Рекомендации по тактике ведения пациента при развитии несостоятельности фиксации
|
Осложнение |
Рекомендации |
|
Перелом/миграция винтов |
Удаление или замена на винты большего диаметра |
|
Усиление фиксации |
Введение транскортикальных винтов в локтевую кость через лучевую. По наблюдению авторов, данная фиксация часто сопряжена с развитием перелома или последующей миграцией винтов, что может быть связано с наличием физиологической ротации лучевой кости относительно локтевой |
|
Перелом, нестабильность «основного» имплантата |
Ревизия, удаление и замена на более длинную «ригидную» пластину с расположением винтов более краниально в проксимальном сегменте лучевой кости |
|
Несостоятельность на уровне запястья, пястных костей |
Можно выполнить смещение пластины с фиксацией на уровне 4-й кости запястья и пясти вместо 3-й (прим.: введение винта в лучевую кость запястья снижает напряжение на проксимальные винты 3-й пястной кости (Shetye, 2011); Дистальные винты (пястные) являются наиболее «слабой» областью фиксации из всей конфигурации протезов (пластин) при ОСО (Shetye, 2011).
|
|
Удаление импланта с заменой на аппарат внеочаговой фиксации (АВФ) |
|
|
Дополнительная фиксация (АВФ, дополнительная пластина на локтевую кость входящая в состав единой конструкции фиксатора;). Использование индивидуального имплантата с двумя пластинами, фиксирующимися на пястные кости (более стабильная фиксация) (Fitzpatrick, 2010).
|
|
|
Некупируемые и тяжелые осложнения или отказ от ОСО |
Ампутация |
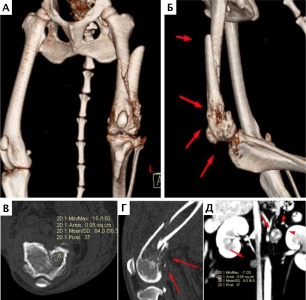
Миграция имплантатов была выявлена у двух пациентов. В одном случае на 238-й день (пациент №1) в виде смещения винта из проксимального сегмента локтевой кости фиксированного LС-DCP пластиной (рис. 35).
А
 Б
Б 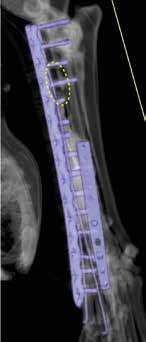 В
В 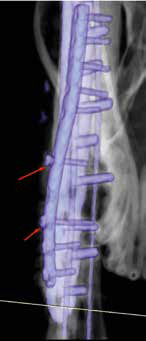
Рис. 35. Пациент №1 (через 238 дней). А-В – контрольное КТ-исследование – онкопоиск.
А – медиолатеральная рентгенограмма и сагитальные КТ-срезы (Б, В) в режиме 3D
(кость-металл). Отмечается местный рецидив (желтый контур) и миграция
кортикальных винтов (В) из LC-DCP пластины (отмечено красными стрелками)
Во втором случае миграция 2-х дистальных уголстабильных винтов была выявлена на 82-й день (пациент №3) из проксимального сегмента локтевой кости (рис. 36).
А
 Б
Б  В
В 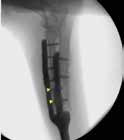 Г
Г 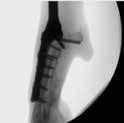
Рис. 36. Пациент №3 (82-й дней). А, Б – контрольные рентгенограммы в медиолатеральной
и краниокаудальной проекции. Выявлена миграция 2-х уголстабильных винтов (желтые
стрелки) из локтевой кости. В, Г – выполнено рентгеноскопическое исследование с оценкой
стабильности имплантата (выполнена мануальная фиксация предплечья + супинация,
пронация) с последующем удалением винтов
Значимого усиления хромоты не отмечалось, однако при пальпации на контрольном осмотре был выявлен умеренный болевой синдром. Было выполнено удаление двух уголстабильных винтов. Стоит отметить, что клинического ухудшения опороспособности и нестабильности фиксации после удаления винтов не было отмечено.
Несостоятельность фиксации при ОСО. Пути решения и профилактика
В случае развития НФ может потребоваться ревизионная хирургия с последующим удалением нестабильных имплантатов. Возможные пути решения данного осложнения представлены в Таблице 1.
Несостоятельность фиксации при ОСХ. Профилактика
Для профилактики данного типа осложнений при выполнении ОСХ может быть рекомендовано (Veterinary Society of Surgical Oncology) (D. Griffon, Jan 2016):
• расположение пластины на всем протяжении сохраненного сегмента лучевой кости;
• подбор адекватных кандидатов на ОСХ с поражением предплечья менее 50% от общей длины;
• использовать длинные, жесткие (ригидные) мостовидные пластины (LCP пластины), коммерческие эндопротезы, предназначенные для ОСХ при аппендикулярной ОС;
• расположение пластины на поверхности костей пясти должно занимать 80% длины и минимум 50% ширины пястной кости;
• расположение винтов в центральной части лучевой кости запястья (os carpi radiale);
• при ОСХ с использованием костного цемента на основе полиметилметакрилата (ПММ) (импрегнированного антибиотиками или без), введение ПММ в ИМ канал может уменьшить частоту расшатывания и миграции винтов и профилактировать нестабильность фиксации [27];
• отмечено, что покрытие имплантата в области контакта (эндопротез-кость) гидроксиапатитом, улучшает остеоинтеграцию кость – металл и может иметь преимущества в более стабильной фиксации в отдаленный период [40];
• использование уголстабильных (блокируемых) винтов (LCP-пластин) уменьшает частоту миграции и расшатывание винтов и несостоятельность фиксации в сравнении со стандартными кортикальными винтами из-за большего рассеивания нагрузки позволяет снизить количество осложнений в виде миграции винтов из проксимального сегмента лучевой кости при ОСО [33] [39], (Рис. 37);
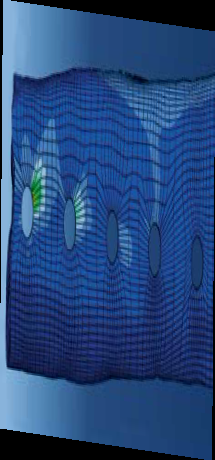
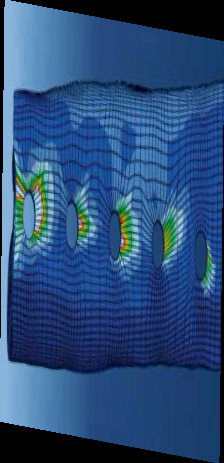
Рис. 37. Биомеханическая сравнительная оценка уголстабильных и стандартных
кортикальных винтов. Отмечается большее рассеивание напряжения (концентрация
нагрузки) в конструкции эндопротеза с уголстабильными винтами (А) в сравнении
с стандартными кортикальными (Б). [Shetye,S., Ryan,S., Ehrhart, N., Puttlitz, C.: Novel
Endoprosthesis for Limb Sparing of Canine Distal Radius Osteosarcoma Patients: A Modular
Approach; 2011, Summer Bioengineering Conference, Colorado State University]
А
Б
• использование модульных систем или индивидуальных протезов фиксирующих одномоментно лучевую +локтевую +3 и 4-ю пястные кости способствует ранней опорной функции конечности и позволяет добиться более жесткой фиксации;
• следует избегать «пустых» (незаполненных винтами) отверстий для профилактики перелома в конфигурации имплантатов «пластина – ПММ или аллотрансплантат», а также «эндопротез – винтовая фиксация»;
• у крупных и гигантских пород собак с относительно «тонкими» кортикальными слоями кости и коротким проксимальным сегментом сохраненной лучевой кости, а также при сочетанном удалении локтевой кости (единым блоком), рекомендовано выполнить дополнительную фиксацию лучевой и локтевой костей пластиной с латеральным расположением.
Для профилактики несостоятельности швов следует, по возможности, минимизировать количество удаленной кожи, для достижения сращения по первичному натяжению.
Местное рецидивирование
Местный рецидив (МР) определяется как рост новообразования на участке ранее выполненного оперативного вмешательства и часто является результатом неполного удаления опухоли или остаточных опухолевых клеток, располагающихся в тканях (неполные или «грязные» края резекции).
Местный рецидив опухоли при ОСХ наблюдается в 20-28% случаев [Morello et al. 2001; Withrow et al. 2004; Liptak et al. 2006a]. По другим данным, сообщалось о МР от 14 до 46% случаев при ОСХ дистального сегмента лучевой кости [Kent et al., 2004; Withrow et al., 1993]. Среднее время манифестации МР варьировало от 80 до 582 дней после операции ([LaRue et al., 1989; Withrow et al., 1993; Morello et al., 2001; Morello et al., 2003; Liptak et al., 2004b; Ehrhart, 2005; Liptak et al., 2006; Hodge et al., 2011].
На сегодняшний день имеются рекомендации по выполнению широкой резекции «блока лучевой и локтевой костей» в соответствии с принципами онкологического радикализма и в связи с потенциальным риском развития местного рецидива на уровне дистальной части локтевой кости, а также в связи с сокращением общего времени операции, так как не требуется тщательная дистальная дисcекция сегмента [33]. Отмечено, что биомеханически нет преимуществ в сохранении дистального сегмента локтевой кости, так как это не приводило к каким-либо изменениям в виде усиления напряжения на проксимальные винты пясти и имеет равноценные прогнозы по осложнениям, ввиду чего многие хирурги выполняют одномоментную сегментарную резекцию лучевой и локтевой костей [Liptak et al.] [31,30].
Таким образом, сегментарная резекция (СР) локтевой кости, при ОСХ может быть выполнена без реконструкции дефекта в случае удаления кости до уровня межкостной связки [39]. При более проксимальной резекции развивается риск луче-локтевой нестабильности с возможным последующим развитием вывиха [9].
Как было отмечено выше, патологический перелом на сегодняшний день не является противопоказанием к проведению ОСХ, так как по результатам исследований при наличии патологического перелома, долгосрочный прогноз аналогичен, как и при ампутации конечности [17, 27] [Jeon et al., 2009]. По результатам исследования аппендикулярной ОС с последующим выполнением ОСХ у 45-ти собак, лишь у 1/4 собак, у которых был патологический перелом, развился местный рецидив вопреки известным рискам локального рецидива, связанного с контаминацией местных тканей опухолевыми клетками [33]. Местный рецидив ОС в проксимальном сегмента лучевой кости был отмечен у 5-ти из 11-ти собак, несмотря на то, что у всех 11-ти были чистые края по результатам послеоперационной гистологии [33]. У 2-х собак были гистологические признаки частично «загрязненных» проксимальных границ, но только у 1-й собаки развился местный рецидив (локтевая кость). Это заставляет пересмотреть современный подход к лечению пациентов с ОС при ПП и в некоторых случаях может быть пересмотрен подход к выбору кандидатов на ОСХ.
К основным факторам риска развития рецидива относятся: выраженная инвазия НО в окружающие мягкие ткани и недостаточно радикальная (неполная) резекция НО.
Для профилактики МР рекомендовано:
• использовать предоперационную визуализацию в виде МРТ или сцинтиграфии для оценки необходимых границ резекции НО при ОСХ;
• использование неоадъювантной терапии (химиотерапия или лучевая терапия), а также методов местного применения (доставки) цисплатина для снижения рисков МР;
• тщательный выбор кандидатов для ОСХ (особенно у пациентов с значимым вовлечением мягких тканей) позволяет избежать неполной резекции пораженного сегмента;
• оценка краев резекции остеотомированного сегмента и образцов костного мозга из ИМ-канала сохранного сегмента проксимальной части лучевой кости после резекции НО, для оценки чистоты краев резекции [9];
• рассмотреть вариант широкой резекции «блока лучевой и локтевой костей» в связи с потенциальным риском развития местного рецидива на уровне локтевой кости.
Лечение
МР можно лечить, используя варианты, аналогичные первичной опухоли кости: ампутация, ОСХ или паллиативное лечение, включающее лучевую терапию, применение бисфосфонатов и анальгетиков. Исходя из экстраполяции данных гуманной медицины, предполагается, что местный рецидив имеет отрицательный эффект на общую выживаемость [27].
Обсуждение и выводы
Основная цель ОСО – раннее функциональное восстановление опороспособности пациента. Это достигается путем широкой сегментарной резекции пораженной кости с последующей реконструкцией сегмента и создания стабильной фиксации между сохранными сегментами конечности.
По множеству опубликованных данных о долгосрочных успешных функциональных результатах ОСХ при аппендикулярной ОС у собак, сегодня стандартная ампутация конечности не должна рассматриваться как лечение первой линии или как стандарт и лечение «по умолчанию».
На сегодняшний день в современной онкоортопедии основным способом реконструкции костного дефекта после сегментарной резекции являются высокотехнологические операции с использованием эндопротезов. Использование модульных систем эндопротезирования признано наиболее актуальным и современным, отвечающим основным требованиям при реконструкции костных дефектов при саркомах кости в гуманной медицине, однако это еще не распространено в ветеринарной медицине [9, 21]. Данная тенденция отмечается и в ветеринарной медицине, являясь перспективным направлением.
Оценка и анализ представленных хирургических техник позволяет сделать ряд выводов, касаемо функциональных результатов, реконструкции костного дефекта после перенесенной ОСХ при аппендикулярных ОС.
Во всех 3-х представленных случаях отмечалась ранняя функциональная опороспособность на оперированную конечность.
Техника №1
Комбинированная техника с использованием ПММ, спиц Киршнера и LСP-пластины с формированием армированного костно-цементного протеза (КЦП) для реконструкции костного дефекта, может быть использована в большинстве случаев. К преимуществам данного способа можно отнести его простоту, дешевизну, пластичность до момента полной полимеризации, а также в случае увеличения объема резекции кости интраоперационно можно адаптировать и изменить костно-цементный протез.
Введение костного цемента в ИМ-канал сохраненной кости после выполнения остеотомии может уменьшить частоту расшатывания и миграции винтов и профилактировать нестабильность самого имплантата [27]. Также данная техника оправдана у животных с тонкими кортикальными слоями костей. Соответственно отверстиям пластины рассверливаются отверстия в кости под винты. Это производится после введения в костномозговой канал цемента, следовательно, винты закручиваются в костный цемент, а не в порозную кость. Это приводит к созданию единой биомеханической структуры: цемент + винты + пластина + кость, что практически исключает возможность расшатывания и миграции фиксаторов в послеоперационном периоде.
Использование спиц Киршнера в КЦП вместе с ПММ позволяет снизить нагрузку на пластину, частично нейтрализуя силы сгибания и смещения [28]. Армирование цемента спицами и винтами способствует усилению прочности фиксации [41]. Согласно ряда данных, армированный костно-цементный протез по биомеханическим показателям превосходит обычный костно-цементный протез. Данная техника может профилактировать перелом пястных костей пациента, вырывание винтов из материнского отломка лучевой кости и перелом имплантата [42].
Введение спиц Киршнера позволяет добиться репозиции по оси и восстановить длину конечности, что создает удобство для последующей работы с ПММ и наложением LCP-пластины. Методология позволяет ввести отдельно спицы в отломок кости и нижележащий сегмент конечности с последующим их соединением на уровне дефекта кости костным цементом (ПММ). Как было отмечено выше, использование уголстабильных (блокируемых) винтов (LCP-пластин) уменьшает частоту миграции и расшатывание винтов [33].
У данного пациента, в отдаленный период наблюдалась периодическая хромота по типу «висячей конечности», что может быть обусловлено недостаточной фиксацией пластины на уровне дистального сегмента конечности (костей запястья, пясти). На основании наблюдений, функциональные результаты после ОСХ зависят от массы тела животного, локализации дефекта кости и прочности фиксирующей конструкции, что отмечено в ряде работ [П.Г.Дюльгер, 2012].
Среди недостатков техники следует отметить сложность достижения адекватной прессуризации цемента в ИМ-канале, неравномерное распределение нагрузки на подлежащую кость при эксцентрически действующих силах, в случае неравномерного распределения ПММ, что в последующем может приводить к нарушению прочности фиксации компонента армированного КЦП [Баитов, 2017].
В сравнении с техникой №2 и №3 данная методология, по нашему опыту, является более трудоемкой по времени и выполнению операционных этапов. Предоперационное планирование на основании данных КТ и моделирование имплантата по «напечатанному» индивидуальному прототипу конечности, изготовленного методом аддитивных технологий, позволяет сократить время операции за счет предоперационного моделирования пластины и отработки хирургической техники на пластиковом макете-образце.
Техника №2. БИОС
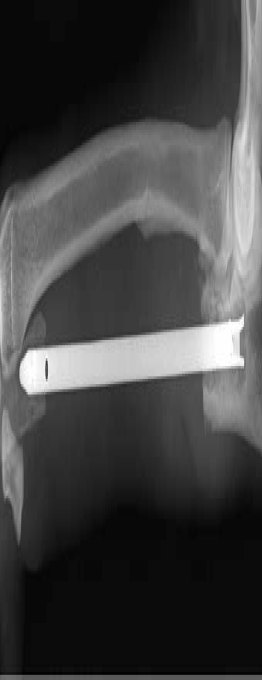
Данная техника включала в себя реконструкцию костного дефекта с помощью БИОС после сегментарной (интеркалярной) резекции локтевой кости. К плюсам данного метода относится простота в использовании, стабильная фиксация с нейтрализацией основных действующих на кость сил. Стоит отметить, что, несмотря на стабильную фиксацию и отсутствия клинической хромоты, у пациента №2 на контрольном рентген-исследовании через 345 суток вокруг блокируемых винтов и в области проксимальной части ИМ стержня была выявлена область резорбции кости (рис. 38).
А
 Б
Б 
Рис. 38. Пациент №2. А, Б – постоперационные рентгенограммы (345-е сутки) после БИОС.
Отмечается зона резорбции костной ткани в области проксимального сегмента локтевой
кости. Несмотря на имеющиеся изменения, клинически не было отмечено усиления хромоты
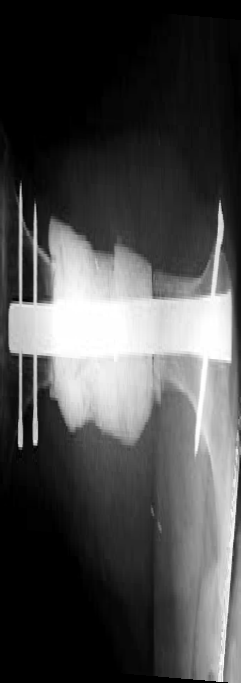
Стоит отметить, что при наличии значительного не реконструируемого дефекта кости нагрузка с одного сегмента кости передается на имплантат и далее снова на сегмент кости. Это, в свою очередь, может привести к нестабильности фиксации в отдаленный период, так как фиксация двумя винтами не является стабильной. Учитывая данное наблюдение и на основании анализа литературы, в долгосрочной перспективе оправдано использовать технику БИОС в комбинированной технике (костноцементный протез). В гуманной медицине с этой целью для усиления фиксации конструкции после сегментарной резекции образовавшийся дефект замещают индивидуальным имплантатом из костного цемента (спейсером), который может быть изготовлен вне операционного поля с последующей фиксацией интрамедуллярным блокируемым стержнем [Н.Н. Карякин, 2017] (рис. 39).
А
 Б
Б 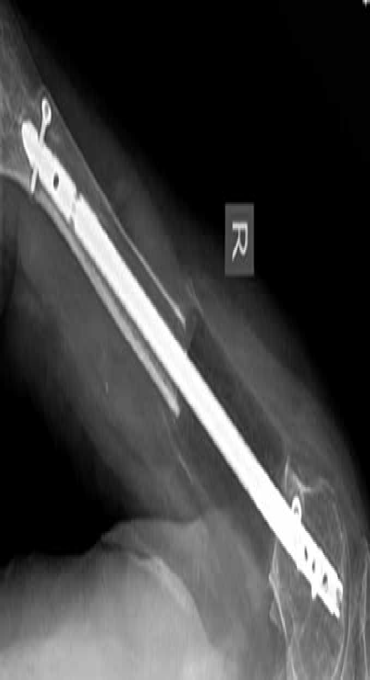
Рис. 39. Сегментарная резекция (интеркалярная) ОС бедренной (А) и плечевой кости
(Б; Рентгенограмма через 1 год после операции) у людей с последующей костной
пластикой образовавшегося дефекта индивидуальным имплантатом из костного
рентгенконтрастного (А) и рентгеноконтрастного цемента и последующей фиксацией
интрамедуллярным стержнем. [Biau, D.J, Pannier, Charles, Glorion: Case Report: Reconstruction
of a 16-cm Diaphyseal Defect after Ewing’s Resection in a Child. First Online: 14 November 2008]
Это способствует созданию конфигурации протеза: кость – винты/ИМстержень – костный цемент – винты/ИМ-стержень – кость.
К недостаткам можно отнести необходимость наличия всего набора системы БИОС с разными типоразмерами имплантатов. Интеркалярная резекция локтевой кости, при ОСО может быть выполнена без реконструкции костного дефекта в случае удаления кости до уровня межкостной связки. Более же проксимальная резекция может быть связана с риском каудального вывиха локтевой кости, что следует учитывать, и в подобных случаях рекомендовано выполнять реконструкцию костного дефекта с последующей фиксацией локтевой кости. ИМ-блокируемый стержень блокируется двумя коническими винтами на проксимальном и на дистальном уровне, что создает стабильную фиксацию.
Техника №3
В данном клиническом случае было реализовано две технологии 3D-печати. Сегментарная резекция была выполнена с использованием «напечатанных» индивидуальных шаблонов (ПХН), что позволяет с точностью до 1 мм выполнить предоперационно спланированную хирургом резекцию НО на требуемом уровне на основании замеров и костных ориентиров, а реконструкция пРКД была выполнена индивидуальным эндопротезом (3D-печать; SLM) из титанового сплава (Ti6AI4V).
Индивидуальные прецизионные хирургические направители
Использование ПХН позволяет сократить время ОСО, так как сформированные отверстия в кости для фиксации ПХН соответствуют отверстиям в уже изготовленном эндопротезе, что требует лишь однократно выполнить рассверливание отверстий в кости, а затем выполнить введение винтов. Таким образом, после выполнения резекции, удаления ПХН и последующего введения эндопротеза в проксимальный сегмент, эндопротез дистальной частью «надевается» на временно фиксируемые в кости спицы Киршнера, чем и достигается первичная репозиция остеотомированных сегментов кости в заданном положении.
Использование ПХН позволяет выполнять остеотомию с предельной точностью именно в пределах заранее спланированной области резекции. Проводить ОСО, по нашим наблюдениям, стоит не позднее 7-10 дней с момента выполнения КТ, так как вторичные изменения в случае прогрессирования ОС (инвазия) могут изменять структуру кости и мягких тканей и не позволить адекватно расположить как направляющие шаблоны, так и сам эндопротез.
Также для сокращения времени оперативного лечения, на поверхности эндопротеза, над винтовыми отверстиями, была выполнена лазерная цифровая разметка длины вводимых винтов.
Так как ПХН выполнены из пластика (фотополимер) к его положительным качествам можно отнести: возможность стерилизации (автоклавирование) и легкость в использовании.
На основании литературных данных и опыта авторов, использование позиционных хирургических направителей может быть сопряжено с рядом осложнений в виде некорректной установки имплантата на кости и, соответственно, ошибки в уровне и линии остеотомии, несостоятельность (разрушение) ПХН при выполнении остеотомии [Н.Н. Карякин, 2017]. Данные осложнения могут быть связаны с допущением ряда ошибок при 3D-планировании хирургом. Профилактировать ряд осложнений возможно при накоплении опыта работы с планированием 3D-объектов при ОСО, ПХН и непосредственно с планировщиком.
К недостаткам использования ПХН стоит отнести их хрупкость (перелом ПХН) при изменении угла пропила и избыточном давлении во время остеотомии, а также при остеотомии на уровне «края паза» ПХН. В данных случаях нами отмечено, что можно выполнить остеотомию через «пропиливание ПХН», путем остеотомии кости и самого паза в ПХН, что не приводит к его ятрогенному расколу, за счет биосовместимости фотополимера не приводит к инфицированию и позволяет выполнить остеотомию на данном уровне с требуемой точностью и в полном объеме. Это особенно актуально при коррекции костных деформаций для выполнения прецизионной остеотомии. Данные осложнения являются ятрогенными и нивелируются с накоплением опыта работы с данными имплантатами.
Использование индивидуальных эндопротезов из титанового сплава (Ti6AI4V) для реконструкции пРКД, изготовленного методом аддитивных технологий, на сегодняшний день является приоритетным направлением в онкоортопедии. Стоит отметить, что благодаря большой прочности и высокой устойчивости к коррозии, титан и его сплавы практически не имеют конкурентов в имплантологии, так как не изменяют своих свойств под влиянием агрессивных биологических сред организма и сами не оказывает токсического воздействия на живые ткании [М.М. Тверской]. Высказаны предположения, что использование эндопротезов из металла вместо аллотрансплантатов снижает частоту инфицирования при ОСО [Liptak et al., 2006].
Применение технологий трехмерной печати в производстве имплантатов обеспечивает их высокую прецизионность и персонифицированность, возможность создания протезов любой формы, сложности и размеров, исходя из требований хирурга под конкретного пациента.
К важным конструктивным особенностям 3D-эндопротеза, относится возможность создания пористой структуры титана в местах контакта с костью, что в последствие позволяет достигать остеоинтеграции. Данных условий невозможно добиться каким-либо другим способом производства, кроме аддитивных методов.
Конфигурация 3D имплантата
По нашему мнению, конфигурация эндопротеза «ИМ стержень фиксируемый методом «плотной посадки» (press-fit) + блокируемая пластина (экстрамедуллярная фиксация), позволяет нивелировать основные силы, действующие на область кость-эндопротез, позволяет добиться адекватной аксиальной поддержки, равномерно распределять нагрузку и создать более прочное соединение, чем аналогичные техники, используемые в монорежиме. По результатам биомеханических исследовании, ИМ-стержень обеспечивает большую площадь контакта с костью, приводит с снижению изгибающих нагрузок на винты в лучевой кости (снижает концентрацию нагрузки) на проксимальные винты лучевой кости [Shetye, 2011] [Fitzpatrick, 2010].
Создание уголстабильных отверстий в эндопротезе, позволяет добиваться более жесткой фиксации, особенно у пациентов с тонкими кортикальными слоями кости [Fitzpatrick, 2010] [Liptak JM D. W., 2006] [D. Griffon, Jan 2016].
К недостаткам метода можно отнести отсутствие модульности эндопротеза. При необходимости интраоперационно изменить уровень резекции или положение эндопротеза, сделать это не представляется возможным, так как эндопротез представляет собой единую монолитную конструкцию. Профилактировать данное осложнение можно, выполняя тщательное предоперационное планирование. Также проводить ОСО стоит не позднее 7-10 дней с момента выполнения КТ, так как за данный период времени, несмотря на химиотерапию, может быть инвазия НО в мягкотканный и/или костный компонент, что неизбежно приведет к невозможности реализации стабильной фиксации эндопротеза, а в худшем случае к местному рецидиву и ампутации в случае не полной резекции (загрязненные края).
Использование двух пластин для фиксации на уровне костей пясти (3 и 4) под уголстабильные винты, обеспечивает более стабильную фиксацию в сравнении с стандартными кортикальными винтами и позволяет достигать ранней опороспособности после ОСО [Shetye, 2011].
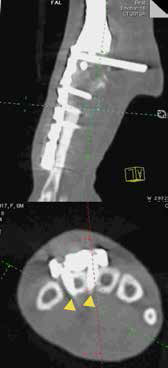
По опыту авторов, несмотря на создание более жесткой конструкции эндопротеза в сравнении с LC-DCP конструкциями, за счет добавления уголстабильных отверстий, корректная бикортикальная фиксация винтов на уровне пястных костей в большинстве случаев не достигается. Это связано с невозможностью введения винтов под необходимым углом, что чаще требуется на практике и приводит к разрушению одного из кортикальных слоев пястных костей. Введение же уголстабильных винтов возможно лишь под углом 90° (рис. 40).
А
 Б
Б 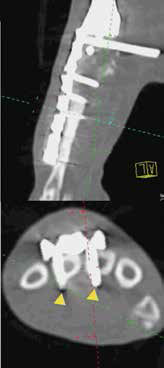 В
В 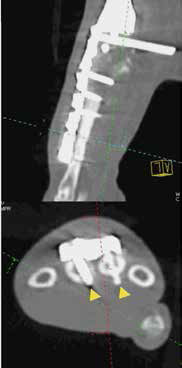 Г
Г 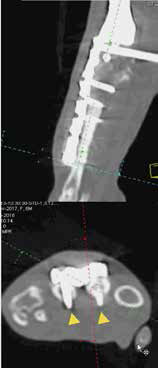
Рис. 40. Пациент №3. А-В – Послеоперационная КТ (сагитальные/аксиальные сканы). А, Б – неполная бикортикальная фиксация винтов
(желтые стрелки) в костях пясти (3; 4 кости) на уровне 1-го, 2-го ряда винтов; бирюзовая линия соответствует аксиальным КТ
сканам ниже). В, Г – корректное бикортикальное введение винтов на уровне 3, 4 ряда пястных винтов
Таким образом, авторы пришли к выводу, что в данном случае при ОСО, а также при создании артродеза на уровне пястных, плюсневых костей при подобных хирургических вмешательствах более оправдано использовать стандартные кортикальные винты, так как их введение можно выполнить под требуемым углом.
Предоперационное планирование ОСО на основании данных КТ с использованием программного обеспечения типа Polygon Medical Engineering, а также в тесном сотрудничестве с биоинженерами, представляет следующий этап развития онкоортопедии и реконструктивной хирургии, позволяя добиваться предсказуемо запланированных результатов и отказаться от «импровизационной» хирургии, что является все еще наиболее распространенным подходом в ветеринарной медицине.
По наблюдению авторов, транскортикальное введение винтов в локтевую кость через лучевую, часто сопряжено с последующим их переломом или миграцией, что в случае с пациентом №3 привело к их асептической нестабильности с последующем удалением (рис. 41).
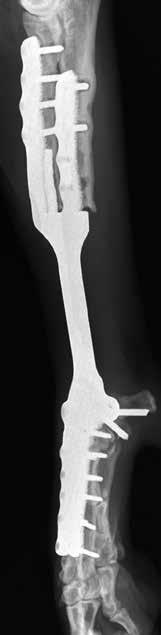
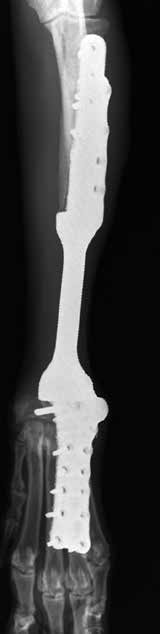
Рис. 41. Пациент №3 (96-й день).
А, Б – контрольные рентгенограммы
в медиолатеральной и краниокаудальной
проекции
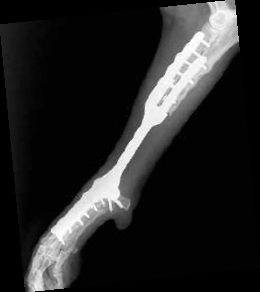
Однако это не привело к общей нестабильности имплантата в отдаленный период (рис. 42).
А
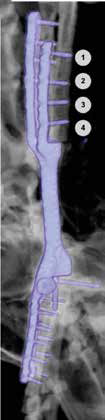 Б
Б 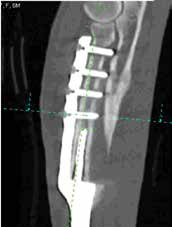 В
В 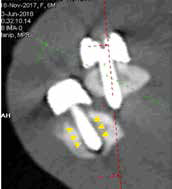 Г
Г 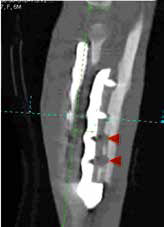 Д
Д 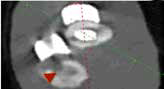 Е
Е 
Рис. 42. Пациент №3. Контрольные КТ до (А-В) и после удаления мигрированных винтов (Г-Е).
В – отмечается область резорбции вокруг 3-го винта локтевой кости (желтые стрелки).
Г-Е – КТ после удаления винтов. Отмечается выраженный дефект костной ткани на уровне уда-
ленного из локтевой кости 4-го винта и область консолидированной кости на уровне 3-го винта
Имеются данные, что это осложнение было отмечено при использовании модульной системы фиксации у собаки при ОСО в виде несостоятельности фиксации в локтевом компоненте эндопротеза и может быть связано с наличием физиологической пронации-супинации лучевой кости относительно локтевой. Требуется в дальнейшем оценка и анализ данного типа осложнения для недопущения развития клинически значимой несостоятельности фиксации.
Заключение
В последнее время органосохранная хирургия уже является стандартом при ОС аппендикулярного скелета у собак во всем мире при условиях правильного подбора кандидатов и без ущерба онкологического радикализма. Использование компьютерной 3D-реконструкции позволяет точно спланировать области хирургической резекции, объем резецируемого фрагмента с последующим его замещением.
Использование аддитивных технологий, а именно персонифицированных ПХН и эндопротезов, создаваемых с применением 3D-печати, позволяет прецизионно и одномоментно заместить костные дефекты любой формы, сложности и размеров, возникающие после удаления опухоли и упростить технику операции, сократив время оперативного вмешательства.
Предоперационное планирование, адекватный подбор кандидатов и пред- и послеоперационная химиотерапии при выполнении ОСО имеют решающее значение и позволяют улучшить результаты лечения пациентов с аппендикулярной ОС.
Создание 3D-моделей (макетов-копий) костей на основании данных КТ на сегодняшний день уже вошло в мировую медицинскую практику и используется для 3D-печати фрагментов костей и конечностей целиком с целью предоперационного планирования и отработки предстоящей операции.
Изготовление индивидуальных эндопротезов методом аддитивных технологий для замещения обширных костных дефектов после перенесенной ОСХ у животных на сегодняшний день имеет актуальность и огромный потенциал, даже больший, чем в гуманной медицине в связи с широкой породной вариабельностью анатомии аппендикулярного скелета у собак.
Пока ограничивающим фактором для распространения и широкого внедрения данного метода в ветеринарную клиническую практику является ценовой диапазон при изготовлении «больших» по размеру эндопротезов с замещением дефекта более 10 см.
На основании представленных данных можно выполнять одномоментную костную пластику пРКД, используя описанные техники, учитывая их преимущества и недостатки, а также локализацию НО, объем необходимой резекции и располагаемые врачом возможности диагностики. Данные техники ОСО могут быть рекомендованы как этап в комплексном лечении аппендикулярной ОС у животных.
Литература
1. Трофимцов, Д., Вилковыский, И., Аверин, М. и др. Онкология мелких домашних животных. Учебное пособие.: Издательство: Научная библиотека, 2017.
2. Outcomes of Limb-Sparing Surgery Using Two Generations of Metal Endoprosthesis in 45 Dogs With Distal Radial Osteosarcoma. A Veterinary Society of Surgical Oncology Retrospective Study. Katherine E. Mitchell, Sarah E. Boston, Marvin Kung, Sarah Dry, Rod C. Straw, Nicole P. Ehrhart, and Stewart D. Ryan. 2016 г., Veterinary Surgery 45 (2016) 36–43.
3. Dernell, WS, Ehrhart, NP, Straw RC, et al: 2007.
4. Kudnig, S.T., Séguin, B. Veterinary surgical oncology. 2015.
5. Ground reaction force analysis of large breed dogs when walking after amputation of a limb. . Kirpensteijn, J, Van Den Bos, R, Van Den Brom WE,et al:. 2000 г., Vet Rec 2000;146:155–159 .
6. Tobias, K., Johnston, A. Veterinary surgery: small animal; Volume Set 2. . б.м. : by Saunders, an imprint of Elsevier Inc, 2012 .
7. Terracini, B, Glickman. LT. 1998 : б.н. Vet J 156:31.
8. Textbook of Small Animal Surgery (3rd ed). Slatter, D.H.
9. Veterinary Society of Surgical Oncology, 2015.
10. Cooley, DM, Beranek, BC, Schlittler, DL, et al,. 2002.
11. Transplantation of ipsilateral canine ulna as a vascularized bone graft for treatment of distal radial osteosarcoma .Zlatinov, V. 2018. February 13, 2018.
12. Методология выполнения органосохраняющих операций в комплексном лечении опухолей костей конечностей у собак и кошек. П.Г. Дюльгер, С.А. Ягников, Ф.А. Любоев, О.А. Кулешова, М.Д. Валюс, Я.А. Кулешова, Т.А. Леонова. 2016 г., Российский ветеринарный журнал.
13. Histologic Grade Does Not Predict Outcome in Dogs with Appendicular Osteosarcoma Receiving the Standard of Care. Schott, C. R., Tatiersky, L. J., Foster, R. A., Wood, G.A. 2017 г., Veterinary Pathology. Reprints and permission: sagepub.com/journalsPermissions.nav DOI: 10.1177/0300985817747329 journals.sagepub.com/home/vet.
14. Imaging Osteosarcoma. Ali Nawaz Khan, Durr-e-Sabih, Klaus L. Irion, Hamdan AL-Jahdali and Koteyar Shyam Sunder Radha Krishna. 2012 г. ISBN: 978-953-51-0506-0, InTech.
15. Accuracy of computed tomography in determining lesion size in canine appendicular osteosarcoma . Ketaki s. Karnik, Samii, V.F. Weisbrode, S.E, London,C.A., Green, E.M. 2012 г., Veterinary Radiology & Ultrasound, Vol. 00, No. 00, 2012, pp 1–6.
16. Fossum, T.W.,. Small Animal Surgery. б.м. St Louis: Mosby; 2012. pg. 1254–1276. Т. 3rd ed.
17. Остеогенная саркома у детей . В.Б.Силков, Т.Д.Викторович, М.Б.Белогурова В.Б.Силков: e-mail silkucci@mail.ru. Ноябрь 2002 г. г., Биомедицинский журнал, Medline.ru , Т. ТОМ 3, стр. 34 (стр. 266).
18. Results of surgery and doxorubicin chemotherapy in dogs with osteosarcoma. . Berg, J, Weinstein, MJ, Springfield, DS, et al. 1995 г., JAVMA206:1555-1560, 1995. .
19. Canine Osteosarcoma: A Naturally Occurring Disease to Inform Pediatric Oncology. Fenger, Joelle M., Cheryl, A. London, William, C. Kisseberth ILAR. [ред.] Published: 01 April 2014. 2014 г., Journal, Volume 55, Issue 1, 1 January 2014, стр. Pages 69–85, https://doi.org/10.1093/ilar/ilu009.
20. Adjuvant therapy for osteosarcoma in dogs: results of randomized clinical trials using combined liposome-encapsulated muramyl tripeptide and cisplatin. Kurzman, I.D, MacEwen, E.G, Rosenthal, R.C, Fox LE, Keller ET, Helfand SC, Vail DM, Dubielzig RR, Madewell BR, Rodriguez CO Jr, et al. 1995 г., Clin Cancer Res. 1995 Dec;1(12):1595-601.
21. Практические рекомендации по лечению первичных злокачественных опухолей костей (остеосаркомы, саркомы Юинга). Феденко А.А., Бохян А.Ю., Горбунова В.А., Махсон А.Н., Тепляков В.В. 2017 г., Рекомендации восточно-европейской группы по изучению сарком: Практические рекомендации RUSSCO #3s2, 2017 (том 7). С. 203–215.
22. Клинические рекомендации по диагностике и лечению больных с первичными злокачественными опухолями кости. Алиев М.Д. Бохян А.Ю., Иванов С.М., Соколовский В.А., Соколовский А.В., Феденко А.А. 2014. Общероссийский союз общественных объединений. Ассоциация онкологов России.
23. Intraosseous transcutaneous amputation prosthesis (ITAP) for limb salvage in 4 dogs.; . Fitzpatrick N, Smith TJ, Pendegrass CJ, Yeadon R, Ring M, Goodship AE, Blunn GW. 2011 г., Vet Surg. 2011 Dec;40(8):909-25. . doi: 10.1111/j.1532-950X.2011.00891.x. Epub 2011 Nov..
24. A system for the surgical staging of musculoskeletal sarcoma. Enneking, W.F., Spanier, S.S., Goodman, M.A. 1980 г., Clin. Orthop. –1980.-Vol.153.-P.106-120.
25. The staging and surgery of musculoskeletal neoplasms.Enneking, WF., Wolf, RE,. 1996 г., OrthopClin N Am 1996;27(3):473-81.):
26. Massive bone loss around the knee - the orthopaedic oncological perspective . Hosking, K. 2012 г., Print version ISSN 1681-150XSA orthop. j. vol.11 n.4 Centurion Jan. 2012.
27. D. Griffon, A,Hamaide. Complications in Small Animal Surgery . [ред.] ISBN: 978-0-470-95962-6. б.м. : Wiley-Blackwell , Jan 2016.
28. Методология выполнения органосохраняющих операций в комплексном лечении опухолей костей конечностей у собак и кошек. П.Г.Дюльгер, С.А.Ягников, Ф.А.Любоев, О.А.Кулешова, М.Д.Валюс, Я.А.Кулешова, Т.А.Леонова. б.н., 2012 г., РВЖ, No 3/2012.
29. Практические рекомендации по диагностике и лечению остеосаркомы у детей подростков. Сенжапова, Э.Р., Дзампаев, А.З., Хестанов, Д.Б. б.м. : НИИ ДОиГ ФГБНУ «РОНЦ им. Н.Н.Блохина , 23.04.2015. http://www.pediatriconcology.ru/helpers/news/1268/.
30. Cortical bone graft and endoprosthesis in the distal radius of dogs: a biomechanical comparison of two different limb-sparing techniques. Liptak JM, Ehrhart N, Santoni BG, et al. Vet Surg 2006;35:150–160.
31. Cortical allograft and endoprosthesis for limb-sparing surgery in dogs with distal radial osteosarcoma: a prospective clinical comparison of two different limb-sparing techniques. . Liptak JM, Dernell WS, Ehrhart N, et al. 2006 г., Vet Surg 2006;35:518–533.
32. Tumors of the skeletal system, in withrow sj, macewen eg (eds): Small Animal Clinical Oncology. Dernell, WS, straw, RC, withrow, SJ. б.м.Philadelphia, WB SAUNDERS, 2001, PP 378-417., 2001 г.
33. Outcomes of Limb-Sparing Surgery Using Two Generations of Metal Endoprosthesis in 45 Dogs With Distal Radial Osteosarcoma. A Veterinary Society of Surgical Oncology Retrospective Study . Mitchell, K.E., Boston, S.E., Kung, М, Dry, S., Straw, R.C. 2015 г., Veterinary Surgery 45 (2016) 36–43 .
34. Limb salvage surgery for osteosarcoma of the proximal humerus: outcome in 17 dogs. . Kuntz, C.A, Asselin, TL, Dernell, WS, Powers, BE, Straw, RC, Withrow, SJ. 1998 г., Vet Surg. 1998 Sep-Oct;27(5):417-22. .
35. Cortical bone graft and endoprosthesis in the distal radius of dogs: a biomechanical comparison of two different limb-sparing techniques. Liptak, JM, Ehrhart, N, Santoni, BG, et al. б.м. : Vet Surg 2006;35:150–160 .
36. Серомы как осложнение хирургического лечения послеоперационных грыж передней брюшной стенки с использованием сетчатых имплантов: современное состояние проблемы. Деговцов, Е.Н., Колядко, П.В. 2018 г., Новости хирургии Том 26 * № 1 * 2018. doi: 10.18484/2305-0047.2018.1.96.
37. Lumachi, F. Seroma prevention following axillary dissection in patients with breast cancer by using ultrasound scissors: a prospective clinical study. Lumachi, A.A. Brandes, P. Burelli et al. 2004 г., Eur. J. Surg. Oncol. — 2004. — 30. — P. 526-30.
38. Клинический случай лечения длительной лимфорреи, возникшей после радикальной мастэктомии. Ивашков, В.Ю. Соболевский, В.А. 2015 г., Поволжский онкологический вестник.
39. Novel Endoprosthesis for Limb Sparing of Canine Distal Radius Osteosarcoma Patients: A Modular Approach. Shetye, S., Ryan,S., Ehrhart, N., Puttlitz, C. Colorado State University : б.н., 2011. DOI: 10.1115/SBC2011-53164 .
40. Novel modular limb salvage endoprostheses for treatment of primary appendicular tumors in dogs: short-term outcome. Fitzpatrick, J. Meswania, G. Blunn. Bologna (Italy) : WVOC 2010, 15th - 18th September, 568 N, 2010.
41. Хирургическое лечение пациентов с опухолями длинных трубчатых костей верхних конечностей с использованием индивидуальных имплантатов из костнозамещающего материала, созданных по технологиям 3D-печати . Н.Н. Карякин, Р.О. Горбатов, А.Е. Новиков, Р.М. Нифтуллаев. б.м. : Том 23, No 3, 2017 г., 2017 г., Журнал клинической и экспериментальной ортопедии им. Г.А. Илизарова.
42. Биомеханические параметры имплантатов при замещении обширных дефектов кости у собак . Дюльгер, П.Г. Ягников, С.А. Гаврюшенко, Н.С. Фомин, Л.В. Кулешова, О.А. Арифуллина Д.В. 2012 г., РВЖ • МДЖ • No 5/2012 .
43. Аутопластика костного дефекта большеберцовой кости при первичном эндопротезировании коленного сустава. Баитов, В.С., Гуражев, М.Б., Прохоренко, В.М. 2017 г., Современные проблемы науки и образования. – 2017. – № 6.
44. Компьютерная технология изготовления медицинских имплантатов методом послойного лазерного спекания . М.М. Тверской, Л.Н. Петрова, А.С. Аладин, Е.Ю. Сулацкая, А.С. Жаринова. Вестник ЮУрГУ, No 23, 2012.
45. Hammer, AS, Weeren, FR, Dickerson, ME, Page, RL,. 2005.

Назад в раздел

















