Чувствительность к антимикробным препаратам микроорганизмов, выделенных от сельскохозяйственных животных и из продукции животноводства
Еще фото
Автор (ы): А. В. Забровская, к.в.н., старший научный сотрудник
Организация(и): ФБУН НИИ эпидемиологии и микробиологии им. Пастера, лаборатория кишечных инфекций
Журнал: №5 - 2012
Аннотация
В настоящее время устойчивость к антибиотикам стала актуальной проблемой для общественного здравоохранения большинства стран мира. Инфекции, вызванные резистентными штаммами Salmonella, E.coli и Campylobacter, могут вызывать у людей тяжелые инфекции со смертельным исходом. Одними из источников таких штаммов для людей являются животные и продукты животного происхождения. Во многих странах мира отмечено увеличение количества резистентных штаммов микроорганизмов, выделенных от животных и из продуктов животного происхождения. Рядом международных организаций (ВОЗ, МЭБ, EFSA) предложены рекомендации по рациональному применению антибиотиков и надзором за резистентностью с целью ограничения распространения резистентных штаммов микроорганизмов.
Начиная с 40-х годов прошлого века антимикробные препараты (АМП) активно применяются в ветеринарии и медицине, и с этого же времени идет непрерывный процесс формирования устойчивости микроорганизмов к АМП, вынуждая фармакологов создавать все новые антибиотики и классы антимикробных препаратов.
В настоящее время устойчивость к антибиотикам стала актуальной проблемой для общественного здравоохранения большинства стран мира. Ежегодно в странах ЕС свыше 25 тыс. человек умирают от болезней, обусловленных антибиотикорезистентными микроорганизмами [22]. Одними из источников этих штаммов для людей являются животные и продукты животного происхождения.
Антибиотики применяются в животноводстве не только для лечения животных, но и в целях профилактики и стимуляции роста, что способствует появлению устойчивых бактерий. Поскольку численность животных превышает численность людей, антибиотики применяются в ветеринарии в больших объемах, чем в медицине. Так как микроорганизмы делятся с большой скоростью, резистентные клоны могут быстро стать доминирующими в бактериальной популяции конкретного биотопа организма животного, поскольку имеют преимущество перед конкурентной чувствительной флорой. Таким образом, носителями резистентных микроорганизмов могут быть даже клинически здоровые животные, получавшие антимикробные препараты для профилактики инфекционных болезней. Устойчивые микроорганизмы могут быть переданы людям при непосредственном контакте с животными, через пищевые продукты и объекты внешней среды. Данные из стран ЕС показывают, что спектр резистентности штаммов сальмонелл, выделенных от свиней, крупного рогатого скота и цыплят, сходен со спектром устойчивости у сальмонелл, выделенных из соответствующих продуктов и от людей [13, 19]. В первую очередь это относится к персоналу, работающему в сельском хозяйстве. По данным ряда авторов, у людей, работающих с животными, чаще выделяют антибиотикорезистентные микроорганизмы из носовой, ротовой полости и из содержимого кишечника [7].
Устойчивость к антибиотикам может быть природной, то есть обусловленной видовыми свойствами микроорганизма (например, устойчивость микоплазм и псевдомонад к β-лактамным антибиотикам или бактерий к антигрибковым препаратам [1]), и приобретенной в результате действия антимикробного препарата на популяцию микроорганизмов. Приобретенная резистентность возникает либо в результате мутации в хромосомной ДНК, либо в результате получения микробной клеткой мобильных генетических элементов (плазмид, интегронов) от других бактерий (горизонтальный перенос генов).
Мобильные генетические элементы представляют большую опасность, так как они быстро передаются в популяции микроорганизмов и могут содержать как один ген резистентности, так и несколько, кодирующих устойчивость к нескольким препаратам одного класса (перекрестная резистентность), или группы генов, обусловливающие устойчивость к нескольким классам АМП (ассоциированная резистентность). Мобильными генетическими элементами могут обмениваться микроорганизмы разных видов, например, представители нормальной микрофлоры животного и патогенной микрофлоры.
Механизмы резистентности
Устойчивость к антимикробным препаратам может быть обусловлена различными механизмами [6]:
1. Модификация мишени действия (например, модификация ДНК-гиразы и топоизомеразы препятствует нарушению репликации ДНК микробной клетки хинолоновыми препаратами);
2. Инактивация антибиотика (расщепление β-лактамных антибиотиков ферментами β-лактамазами);
3. Активное выведение антибиотика из микробной клетки – эффлюкс (выведение тетрациклина грамположительными и грамoтрицательными микроорганизмами)
4. Нарушение проницаемости внешних структур микробной клетки (утрата пориновых каналов делает невозможным проникновение β-лактамного антибиотика внутрь грамотрицательной клетки);
5. Формирование метаболического шунта (устойчивость к сульфаниламидам и ко-тримоксазолу.
Определение чувствительности микроорганизмов к антибиотикам
В современных бактериологических лабораториях определение чувствительности микроорганизмов к АМП может осуществляться автоматическим и неавтоматическим способом. В рутинной бактериологической практике используются автоматические приборы типа VITEK, которые определяют пороговые значения минимальной ингибирующей (или подавляющей) концентрации АМП (МИК или МПК), относительно которых исследуемые микроорганизмы делятся на чувствительные, резистентные (устойчивые), или имеющие промежуточное значение резистентности. Интерпретация результатов зависит от критериев оценки, заложенных в экспертную систему прибора. Существуют международные системы критериев, разработанные EUСАST (European Committee on Antimicrobial Susceptibility Testing) и CLSI (Clinical and Laboratory Standards Institute), которые довольно значительно отличаются. В исследовательских лабораториях ведется целенаправленный поск генетических детерминант резистентности методом ПЦР, ПЦР в реальном времени или методом масс-спектрометрии.
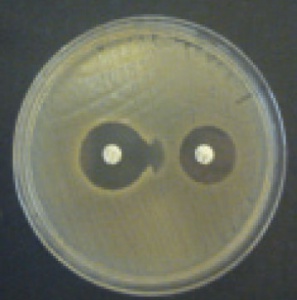
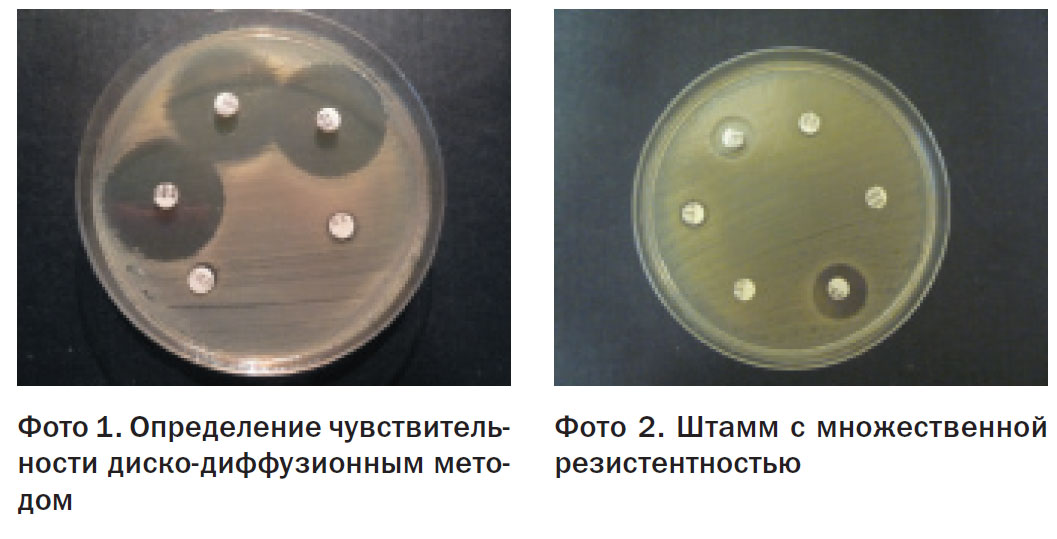
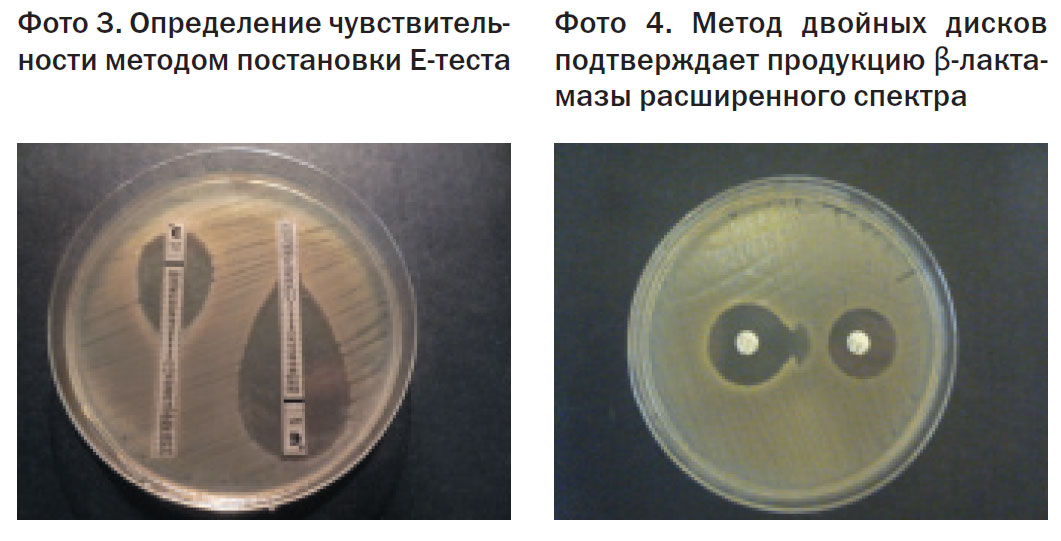
Для определения чувствительности микроорганизмов неавтоматическим методом в нашей стране разработаны методические рекомендации (МУК 4.12.1890-04.) [5]. Согласно этому документу, чувствительность может определяться либо путем установления МПК методом серийных разведений в жидкой или твердой питательной среде, либо измерением зоны задержки роста микроорганизма при использовании диско-диффузионного метода. Для быстрого определения МПК одного антибиотика существуют Е-тесты – полоски, пропитанные антибиотиком в градиенте концентрации, которые накладываются на плотную питательную среду, засеянную тестируемым микроорганизмом. Рядом ведущих фирм, выпускающих реактивы и расходные материалы для лабораторных исследований (Hi-Media, Lachema и др.) для определения чувствительности разработаны планшеты с лунками, в которые внесены определенные АМП в пограничных концентрациях, в которые достаточно добавить взвесь исследуемого микроорганизма.методом постановки Е-теста подтверждает продукциюβ-лактамазы расширенного спектра
Распространение антибиотикорезистентных штаммов у животных
Наибольшее эпидемиологическое значение имеет увеличение количества резистентных штаммов бактерий – возбудителей инфекционных заболеваний, общих для человека и животных. Такими микроорганизмами являются представители родов Salmonella, Campylobacter, а также штаммы E.coli, обладающие различными факторами вирулентности, которые обусловливают развитие патологического процесса в организме.
Обычно источниками резистентных штаммов Salmonella и Campylobacter являются клинически здоровые животные. Особенную озабоченность у медицинских работников вызывает все возрастающая устойчивость данных микроорганизмов к АМП класса хинолонов и цефалоспоринов, так как эти две группы препаратов входят в составленный ВОЗ список антибиотиков, имеющих критическое значение для медицины.
Установлена статистически достоверная связь между антибиотикорезистентностью сальмонелл и более частыми и длительными госпитализациями пациентов, больных сальмонеллезом, более тяжелым течением заболеваний и высоким риском развития инвазивных форм инфекции, а также двукратным увеличением риска смертельного исхода в течение двух лет после инфицирования.
C начала 1960-х годов в Европе появилось несколько клонов S.Typhimurium, обладающих множественной резистентностью к широкому спектру препаратов, в том числе и к включенным в список препаратов, критически важных для медицины. Такие клоны принадлежали к определенным фаговарам (29, 204, 103 и 104), часто выделяемым как от животных (в основном, среди свиней), так и от людей. Эти штаммы быстро распространились среди животных и стали причиной большого количества заболеваний людей в странах ЕС, в том числе и со смертельным исходом [16]. В частности, при заболеваниях, обусловленных полирезистентными штаммами Salmonella Typhimurium фаговара DT 104, устойчивого к хинолонам, наблюдали неудачи лечения, более высокую частоту госпитализации и более высокий риск смертельного исхода.
К началу 2000-х годов S.Typhimurium этого фаговара стали выделяться реже. В настоящее время пробрел актуальность монофазный по Н-антигену вариант S.Typhimurium 4,[5],12:i:-. Эта группа серологически однородных штаммов разных фаговаров (U302, DT193, DT120, DT191a и другие) с разными профилями множественной резистентности в 2006 году стала в Европе четвертой из наиболее часто встречающихся у людей сальмонелл. Источником этих сальмонелл являются чаще всего свиньи и продукция свиноводства, реже – другие продукты питания животного происхождения [16, 17].
Возбудители кампилобактериоза очень легко приобретают устойчивость к антибиотикам. Рост устойчивости к фторхинолонам у штаммов кампилобактеров, выделенных от людей, связан с применением препаратов этого класса у животных. Во многих странах кампилобактеры, выделенные из мяса птиц, а также от свиней и крупного рогатого скота, были резистенты к АМП, в том числе фторхинолонам (9, 10, 18).
В странах, где фторхинолоны запрещены к использованию у сельскохозяйственных животных или применяются рационально (Австралия, Дания, Норвегия), результаты исследований свидетельствуют о низких масштабах распространенности устойчивости к фторхинолонам среди кампилобактеров, хотя эти препараты применяются в медицине более 20 лет. В то же время в странах, где фторхинолоны у сельскохозяйственных животных активно используются в настоящее время или применялись ранее (Испания, Китай, США), у штаммов кампилобактеров, выделенных от сельскохозяйственных животных и людей устойчивость к этим препаратам обнаруживается чаще [9, 10, 18, 21].
Проведенные исследования показали, что устойчивость кампилобактерий к макролидам обусловливает неудачи лечения и более длительное выздоровление, а также необходимость применения альтернативных антибиотиков, отмечается увеличение частоты инвазивных форм и летальных исходов [10, 15].
В настоящее время в странах ЕС частота устойчивости к эритромицину штаммов Campylobacter jejuni, чаще выделяемых от домашней птицы, составляет менее 15%. Уровень устойчивости к эритромицину у Campylobacter coli, обычно выделяемых от свиней – 20%, в отдельных странах до 70%. Такое явление можно объяснить выбором конкретного препарата ветеринарными специалистами в свиноводческих хозяйствах.
Штаммы E.coli животного происхождения, контаминирующие пищевые продукты, являются потенциальным источником генов устойчивости к АМП. Колонизация организма человека устойчивым штаммом E.coli приводит к передаче генов резистентности другим бактериям, в том числе и патогенным, что приводит к более длительному и тяжелому течению вызываемых ими болезней.
В настоящее время вызывает тревогу быстрое распространение штаммов E.coli, продуцирующих БЛРС, обладающих устойчивостью к цефалоспоринам третьего и четвертого поколений с широким спектром антибактериального действия. Это особенно опасно в связи с тем, что данные бактерии нередко проявляют устойчивость и к другим АМП первой линии, например, фторхинолонам.
В последние годы выделение штаммов E.coli, продуцирующих БЛРС, было отмечено как при заболеваниях людей, так и от сельскохозяйственных животных, например, от крупного рогатого скота и домашней птицы, в особенности, от цыплят. Это позволяет предположить, что пищевые продукты и окружающая среда могут стать важными факторами распространения этих устойчивых бактерий [8].
В современных условиях глобализации экономики географические границы не могут повлиять на распространенность резистентных к антибиотикам микроорганизмов. Увеличение количества устойчивых штаммов, выделенных от животных и из продукции животноводства, отмечены и в нашей стране. По данным лаборатории кишечных инфекций НИИЭМ имени Пастера, доля резистентных к АМП сальмонелл животного происхождения, выделенных на территории Ленинградской области, в настоящее время составляет 49%, в то время как в 1986 – 1996 гг. таких штаммов было около 8% от общего количества. Отмечен достаточно высокий удельный вес штаммов сальмонелл, резистентных к β-лактамным препаратам (17,9% в 2004 – 2010гг по сравнению с 8,8% в 1986 – 1996 гг.), однако, β-лактамазы расширенного спектра были обнаружены только у сальмонелл, выделенных из импортной продукции птицеводства, что свидетельствует об относительном благополучии территории Ленинградской области по циркуляции данного вида штаммов. Активное применение в ветеринарии препаратов хинолонового ряда привело к появлению резистентных штаммов. В настоящее время к налидиксовой кислоте устойчиво более 42% штаммов сальмонелл, в то время как 20 лет назад таких штаммов не было [3]. Возросло количество штаммов, устойчивых к нескольким АМП. На территории Ленинградской области выделены S.Typhimurium, имеющие профиль резистентности, идентичный описанному в литературе штамму S.Typhimurium DT104, который характеризуется устойчивостью к хлорамфениколу, ампициллину, тетрациклину, стрептомицину и сульфаниламиду.
Штаммы энтеробактерий (E.coli, Proteus), а также Pseudomonas aeruginosa, выделенные от животных и из продукции животноводства, были более устойчивы к антибактериальным препаратам, чем сальмонеллы: более 90% обладали резистентностью к 1-9 антимикробным препаратам. К хинолонам было резистентно 62,9% штаммов, причем большинство из них было устойчиво и к следующему поколению – фторхинолонам (энрофлоксацин). К β-лактамным препаратам было устойчиво 44% исследованных штаммов, причем треть из этих штаммов были также устойчивы и к цефалоспоринам III поколения, методом двойных дисков было подтверждено наличие у этих штаммов β-лактамазы расширенного спектра.
Кроме того, в отличие от сальмонелл, среди представителей условно-патогенной микрофлоры встречались штаммы, устойчивые к хлорамфениколу и полимиксину [4].
Пути решения проблемы антибиотикорезистентности
Всемирная организация здравоохранения уделяет большое внимание сдерживанию распространения антибиотикорезистентных штаммов микроорганизмов с позиции безопасности пищевых продуктов для населения.
Для понимания причин возникновения и тенденций распространения резистентности к антибиотикам необходим мониторинг за устойчивостью к антибиотикам зоонозных и сапрофитных бактерий, выделенных от различных сельскохозяйственных животных и из продукции животноводства. Такой мониторинг должен включать непрерывный сбор информации о частоте выделения резистентных штаммов, ее анализ и публикацию результатов, что позволит осуществлять надзор за устойчивостью к антибиотикам, а также позволяет идентифицировать специфические случаи резистентности (как, например, у S.Typhimurium DT104).
Экспертами ВОЗ самостоятельно, а также совместно с ФАО (продовольственная и сельскохозяйственная организация) и ВОЗЖ (всемирная организация охраны здоровья животных) даны рекомендации, согласно которым создание национальных программ надзора за применением антибиотиков у сельскохозяйственных животных и устойчивостью микроорганизмов, выделенных от животных и из продукции животноводства, имеет большое значение для разработки мероприятий национального и международного масштаба, направленных на сдерживание устойчивости к антибиотикам.
Европейское управление по безопасности пищевых продуктов (Еuropean Food Safety Authority – EFSA) подготовило рекомендации по надзору за устойчивостью к антибиотикам сальмонелл и кампилобактеров [12], а также индикаторных штаммов E.coli и энттерококков [11], в которых указана необходимость сокращения неоправданного применения антибиотиков в целях ограничения распространения резистентных микроорганизмов.
ВОЗ дает следующее определение рационального использования АМП: «экономически целесообразное применение антимикробных средств, которое обеспечивает максимальную терапевтическую активность и в то же время сводит к минимуму токсичность препаратов и возможность формирования устойчивости» [2]. Этого можно добиться, улучшая санитарно-гигиенические условия содержания животных и при переработке продукции животноводства, а также предупреждая заболевания животных, благодаря применению вакцин и других профилактических мер, например, использованию пробиотиков (полезные бактерии, находящиеся в различных кормах), пребиотиков (неперевариваемые корма, которые способствуют размножению индигенных бактерий) или заместительных препаратов (представители номальной кишечной флоры, которые ограничивают колонизацию кишечника некоторыми патогенными микроорганизмами).
Поскольку было показано, что применение антибиотиков в качестве стимуляторов роста сельскохозяйственных животных связано с угрозой для здоровья людей, с 2006 года в странах ЕС запрещено использование любых антибиотиков в этих целях.
Политика отказа от применения антибиотиков как стимуляторов роста не привела к снижению производства продукции животноводства, но послужила причиной уменьшения удельного веса резистентных штаммов (в частности, ванкомицин-резистентных Enterococcus faecium), в популяции микроорганизмов как у животных, так и у людей [14].
Литература
1. В.Д.Бадиков. Микробиологические основы антимикробной терапии инфекционных заболеваний. Руководство для врачей. – Санкт-Петербург. – 2005. – 183с.
2. Глобальная стратегия ВОЗ по сдерживанию устойчивости к противомикробным препаратам» Женева, Всемирная Организация Здравоохранения, 1998 (http://www.who.int/drugresistance/WHO_Global_Strategy_Russian.pdf, по состоянию на 22 марта 2011 г.)
3. А.В.Забровская, Л.А.Кафтырева, С.А.Егорова, Л.В.Селиванова, Л.Ю.Малышева, Н.А.Антипова, А.Н.Борисенкова, О.Б.Новикова. Устойчивость к антимикрбным препаратам сальмонелл, выделенных от животных и из продуктов в Ленинградской области в 2004 – 2010гг. – Международный вестник ветеринарии. - №3. – 2011. – с.15 – 18
4. Забровская А.В., Кафтырева Л.А., Егорова С.А., Селиванова Л.В., Малышева Л.Ю., Антипова Н.А., Борисенкова А.Н., Новикова О.Б. Мониторинг чувствительности к антимикробным препаратам микроорганизмов, выделенных из пищевых продуктов животного происхождения в 2004 – 2010 гг. - Материалы XXXXIV научной конференции Хлопинские чтения «Эколого-гигиенические и клинические проблемы управления здоровьем населения». – СПб. – 2011. - с.115-117
5. Методические указания по определению чувствительности микроорганизмов к антибактериальным препаратам. Методические указания МУК 4.12.1890-04. – Минздрав России. – Москва, 2004. –65 с.
6. Практическое руководство по антимикробной химиотерапии.//Ред. Л.С. Страчунского, Ю.Б.Белоусова, С.Н.Козлова. – Смоленск:МАКМАХ, 2007. – 464с.
7. Aubry-Damon Y., Grenet K. et al. Antimicrobial Resistence in Commensal Flora of Pig Farm. – Emerging Infectious Diseases. – 2004 May;10(5):8773-9
8. Collignon P. Resistant Escherichia coli – we are what we eat. – Clinical Infectious diseases. – 2009. – 49(2):202 - 204
9. Endtz H.P. et al. Quinolone resistance in campylobacter isolated isolated from man and poultry following the introduction of fluoroquinolones in veterinary medicine. – Journal of Antimicrobial Chemotherapy. – 1991. – 27(2):119-208
10. European Centre for Disease Prevention and Control et al. Joint opinion on antimicrobial resistance (AMR) focused on zoonotic infections. Scientific Opinion of the European Centre for Disease Prevention and Control; Scientific Opinion of the Panel on Biological Hazards; Scientific Opinion of the Scientific Committeeon Emerging and Newly Identified Health Risks. – EFSA Journal – 2009. – 7(11):1372 (http://www.efsa.europa.eu/it/efsajournal/doc/1372.pdf, accessed 21 January 2011).
11. European Food Safety Authority. Report of the Task Force of Zoonoses Data Collection including guidance for harmonized monitoring and reporting of antimicrobial resistance in commensal Escherichia coli and Enterococcus spp. from food animals. EFSA Journal. – 2008. – 141:1 – 44 (http://efsa.europa.eu/en/efsajournal/doc/141r.pdf, accessed 7 February 2011)
12. European Food Safety Authority. Report of the Task Force of Zoonoses Data Collection including a proposal for harmonized monitoring scheme of antimicrobial resistance in Salmonella in fowl (Gallus gallus), turkeys and pigs and Campylobacter jejuni and C.coli in broilers. EFSA Journal. - 2007. – 96:1-46http://www.efsa.europa.eu/fr/efsajournal/doc/doc/96r/pdf, accessed 7 February 2011)
13. European Food Safety Authority. The Community summary report on antimicrobial resistance in zoonotic agents from animals and food in the European Union in 2004 - 2007. – EFSA Journal. – 2010. – 8(4):1309-1615.
14. Hammerum A.M. et al. Danish integrated antimicrobial resistance monitoring and research program. // Emerging Infectious Deseases. - 2007. – 13(11):1632-1639
15. Helms M. et al Adverse health events associated with antimicrobial drug resistance in Campylobacter species: a registry-based cohort study. – Journal of Infectious Diseases. – 2005. – 191(7):1050-1055
16. Hopkins K.L. et al. Multiresistant Salmonella enteric serovar 4:[5],12:i:- in Europe: a new pandemic strain? Eurosurveillance, 2010, 15(22):1-9 (http://www.eurosurveillance.org/images/dynamic/EE/V15N22/art19580.pdf, accessed 7 February 2010.
17. K.L.Hopkins, E.de Pinna, J. Wain Prevalence of Salmonella enteric serovar 4,[5],12:i:- in England and Wales, 2010 http://www.eurosurviellance.org/ViewArticle/aspx?Articled=20275
18. Joint FAO/OIE/WHO Expert Workshop on Non-Human Antimicrobial Usage and Antimicrobial Resistance: scientific assessment: Geneva, 1 – 5 December 2003. Geneva, World Health Organisation, 2004 (http://www.who/int/foodsafety/publications/micro/en/amr.pdf, accessed 20 January 2011).
19. Meakins S. et al. Antimicrobial drug resistance in human non-typhoidal Salmonella isolates in Europe 2000-04: a report from the Enter-net international surveillance network. – Microbial Drug Resistance (Larchmont. NY). – 2008. – 14:31-35
20. Mevius et al. eds MARAN 2008: monitoring of antimicrobial resistance and antimicrobial usage in animals in the Netherlands in 2008. Lelystad, Veterinary Antibiotic Usage and Resistance Working Group, 2010 (http:/www.cvi.wur.nl/NR/rdonlyres/DDA15856-1179-4CAB-BAC6-28C4728ACA03/110563/MARAN_2008_definitief_corrected.pdf, accessed 4 February 2011)
21. Panel on Biological Hazards. Scientific Opinion of the Panel on Biological Hazards on a request from the European Food Safety Authority on foodborne antimicrobial resistance as a biological hazard. – EFSA Journal. – 2008. – 765:1 – 87
22. The bacterial challenge: time to react – a call to narrow the gap between multidrug-resistant bacteria in the EU and the development of new antibacterial agents. Stockholm, European Centre for Disease Prevention and Control, 2009 (http://ecdc.europa.eu/en/publications/Publications/0909_TER_The_Bacterial_Challenge_Time_to_React.pdf, accessed 20 January 2011)

Назад в раздел

















