Современный механизм иммуномодуляции
Еще фото
Автор (ы): И.А. Шикунова, ветеринарный врач скорой ветеринарной помощи «Аристей», ведущий ветеринарный специалист компании ЗАО «ПЕПТЕК»
Журнал: № 1-2 - 2012
На правах рекламы
Введение
Новый взгляд на роль врожденного иммунитета в естественной и приобретенной невосприимчивости к инфекции открывает перспективы целенаправленного управления этим процессом с помощью вакцин, иммуномодуляторов и других фармакологических препаратов, механизм действия которых доказан фундаментальными исследованиями. В этой связи Гликопин® представляет собой один из немногих ветеринарных иммуномодуляторов с известным и предсказуемым механизмом действия, а уникальной особенностью препарата является сочетание высокого иммуномодулирующего эффекта с абсолютным отсутствием побочных действий.
Структура Гликопин® представлена глюкозаминилму-рамилдипептидом (ГМДП), который является синтетическим аналогом мурамилдипептида – биологически активного минимального фрагмента клеточной стенки грамположительных и грамотрицательных бактерий. ГМДП был разработан российскими учеными в Институте биоорганической химии им. М. М. Шемякина и Ю. А. Овчинникова РАН и при сотрудничестве с ВНИИЭВ им. Я. Р. Коваленко РАСХН был успешно доведен до лекарственной формы. Труд ученых по созданию биотехнологического производства нового иммунномодулирующего лекарственного препарата был удостоен правительственных премий и наград.
История открытия
История изучения влияния мурамилпептидов и, в частности, ГМДП на иммунную систему и организм в целом насчитывает уже более 35 лет. За это время были проведены сотни фундаментальных исследований, как в России, так и за рубежом и получено множество фактического материала. Данные экспериментальных исследований дополнялись результатами клинических испытаний препарата Гликопин® в ветеринарии и препарата Ликопид® - в медицине. Одним из важнейших достижений недавнего времени можно считать изученность механизмов действия ГМДП и выявление молекулярной мишени для него в иммунной системе.
Начало исследованиям биологических и терапевтических свойств мурамилдипептидов (МДП) было положено открытием в 1974 году Эдгаром Ледерером и его соавторами того, что именно МДП является минимальным компонентом, обуславливающим иммуностимулирующее действие адъюванта Фрейнда и способным заменить в его составе микобактерию туберкулеза. Э. Ледерер успешно выделил активный адъювантный компонент – мурамилпептид, состоящий из одной молекулы сахара и двух аминокислот. С того времени было синтезировано большое количество МДП и детально изучены их биологические эффекты. Однако проблема клинического применения МДП состояла в том, что он давал значительную пирогенную реакцию.
Впоследствии в Институте биоорганической химии им. Шемякина (г. Москва) группой ученых под руководством профессора В. Т. Иванова и доктора Т. М. Андроновой был выделен МДП из других бактерий – Lactobacillus bulgaricus. В целом он был идентичен МДП, выделенному французами, однако в его структуру была включена еще одна молекула сахара – N-ацетилглюкозамин, в связи с чем это соединение получило название глюкозаминилмурамилдипептид (ГМДП). ГМДП имел весомое преимущество перед МДП микобактерий, так как был гораздо менее токсичным, но при этом обладал иммуномодулирующей активностью. Следующим шагом на пути к клиническому применению ГМДП было производство его больших количеств. В частности, группой ученых под руководством Т. М. Андроновой был успешно разработан новый метод синтеза ГМДП. При этом дисахарид выделяли из клеточной стенки бактерий, а дипептид получали методами химического синтеза, соединяя в последующем две молекулы.
Несмотря на успехи в исследовании биологических свойств МДП и перспектив их практического применения, молекулярный механизм их действия долгое время оставался малоизученным. Многие лаборатории мира пытались найти рецептор, распознающий мурамилпептиды, предполагая изначально, что это рецептор, находящийся на поверхности клетки. Однако в 1991 году группе ученых под руководством профессора В.А. Несмеянова в ИБХ РАН удалось обнаружить рецептор с полной специфичностью к мурамилпептидам не снаружи, а внутри клетки.
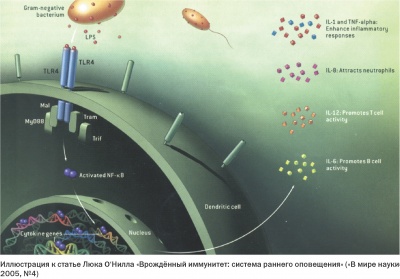
Тем временем прогресс экспериментальной биологии в конце 20-го столетия обусловил прорыв в исследованиях клеточных и молекулярных механизмов иммунитета. Это относится, в первую очередь, к пересмотру ранее сложившихся представлений о роли врожденного иммунитета в общей системе защитных реакций организма. Были получены новые фундаментальные данные о механизме создания невосприимчивости к инфекции и поддержания гомеостаза организма, открыты Толл-подобные рецепторы (Toll-like receptor, TLR), расположенные в цитоплазме иммунокомпетентных клеток, распознающих антигены микроорганизмов и активирующих врожденный иммунный ответ.
Существенно прояснить работу врожденного иммунитета удалось Брюсу Бойтлеру и Жулю Хоффманну. Так, впервые в 1996 году Жюль Хоффманн обнаружил ген, отвечающий за развитие иммунного ответа на микотическую инфекцию, а в 1997 году Руслан Меджитов (выходец из СССР) и Чарльз А. Джейнуэй показали, что у людей существует Толл-подобный рецептор, активирующий гены, необходимые для индукции иммунного ответа.
Брюс Бойтлер, изучая жизнедеятельность мышей и их реакцию на болезнетворные бактерии, в 1998 году обнаружил ген, который отвечает за противостояние этим бактериям. При этом было выявлено, что данный ген соответствует гену, открытому ранее его коллегой Хоффманом и является Толл-подобным рецептором, описанным Р. Меджитовым. Впоследствие Брюс Бойтлер и Жюль Хоффманн за это открытие были удостоены Нобелевской премии 2011 года в области медицины.
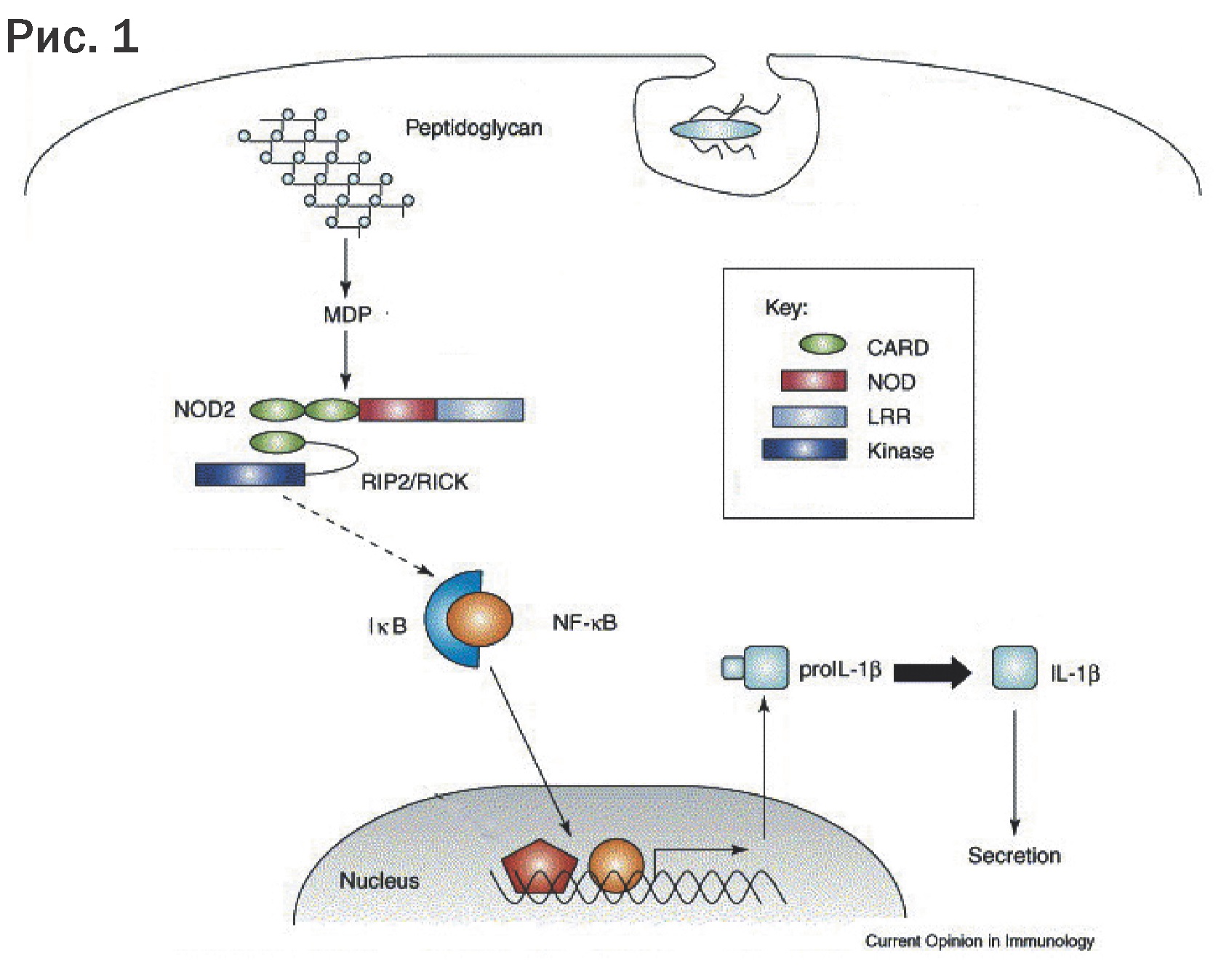
Несмотря на научные успехи в данном направлении, природа рецептора, распознающего ГМДП, оставалась неясной вплоть до 2003 года, когда независимыми исследованиями научных сотрудников из института Пастера и Исследовательского центра макромолекулярной биохимии были получены сходные результаты, имеющие большую научную значимость. Учеными был идентифицирован внутриклеточный рецептор к МДП как молекула NOD2 – рецептор врожденного иммунитета. Таким образом, впервые механизм молекулярного действия ГМДП через рецептор врожденного иммунитета был описан в журнале «Биологическая химия» (США) в июле 2003 года.
Механизм молекулярно-биологической активности
В последние годы было продемонстрировано, что взаимодействие ГМДП-NOD2 является абсолютно специфичным. В частности, любые изменения в структуре ГМДП приводят к отсутствию связывания с рецептором. Это доказывает, что ГМДП является истинным минимальным биологическим фрагментом для NOD2 рецептора. NOD2-рецепторы были обнаружены, в основном, в фагоцитирующих клетках – моноцитах/макрофагах, гранулоцитах, дендритных и эпителиальных клетках, которые обеспечивают начальные и конечные фазы иммунного ответа. Связывание ГМДП, как активного действующего вещества Гликопина® с NOD2-рецепторами, приводит к целой серии событий внутри клетки, заканчивающейся активацией фактора транскрипции NF-kB, проникающего в ядро и включающего синтез множества генов, кодирующих цитокины, которые вызывают стимуляцию эффекторных функций фагоцитов (поглощение и переваривание фагоцитами микробов – микробоцидную функцию, цитотоксическую – по отношению к вирусинфицированным клеткам, функцию презентации антигенов), а также стимуляцию пролиферации Т- и В- лимфоцитов, повышение синтеза специфических антител (т.е. усиление адаптивного иммунного ответа) и восстановление нарушенного Т-хелперного баланса. Достаточно сказать, что ГМДП-индуцированная стимуляция синтеза ключевых интерлейкинов (ИЛ-1, ИЛ-6, ИЛ-12); фактора некроза опухолей (ФНО) приводит к значительной активации противоопухолевого иммунного ответа. Усиление продукции колониестимулирующих факторов (КСФ) приводит к стимуляции лейкопоэза с восстановлением числа циркулирующих гранулоцитов; усиление синтеза гамма-интерферона приводит к повышению активности естественных киллерных клеток, играющих важную роль в противоопухолевой защите.
Таким образом, Гликопин® активирует все звенья иммунной системы, что в конечном итоге приводит к усилению как противоинфекционного, так и противоопухолевого иммунитета. Между тем известны и неимунные биологические эффекты Гликопина®, суть которых заключается в стимуляции синтеза в печени цитохрома Р-450, оказывающего детоксицирующее действие, и в транквилизирующем успокаивающем действии на центральную нервную систему.
Фармакокинетика
Изучение фармакокинетики Гликопина® было проведено на кроликах (в России), крысах и собаках (в Великобритании) с использованием радиохимически чистого
14С-Гликопина (14С-ГМДП).
Абсолютная биологическая доступность 14С-Глико-пина при пероральном введении составляла 76.7%.
Безопасность
При однократном внутрибрюшинном введении Гликопина белым мышам значение LD50 составляет 7000 мг/кг.
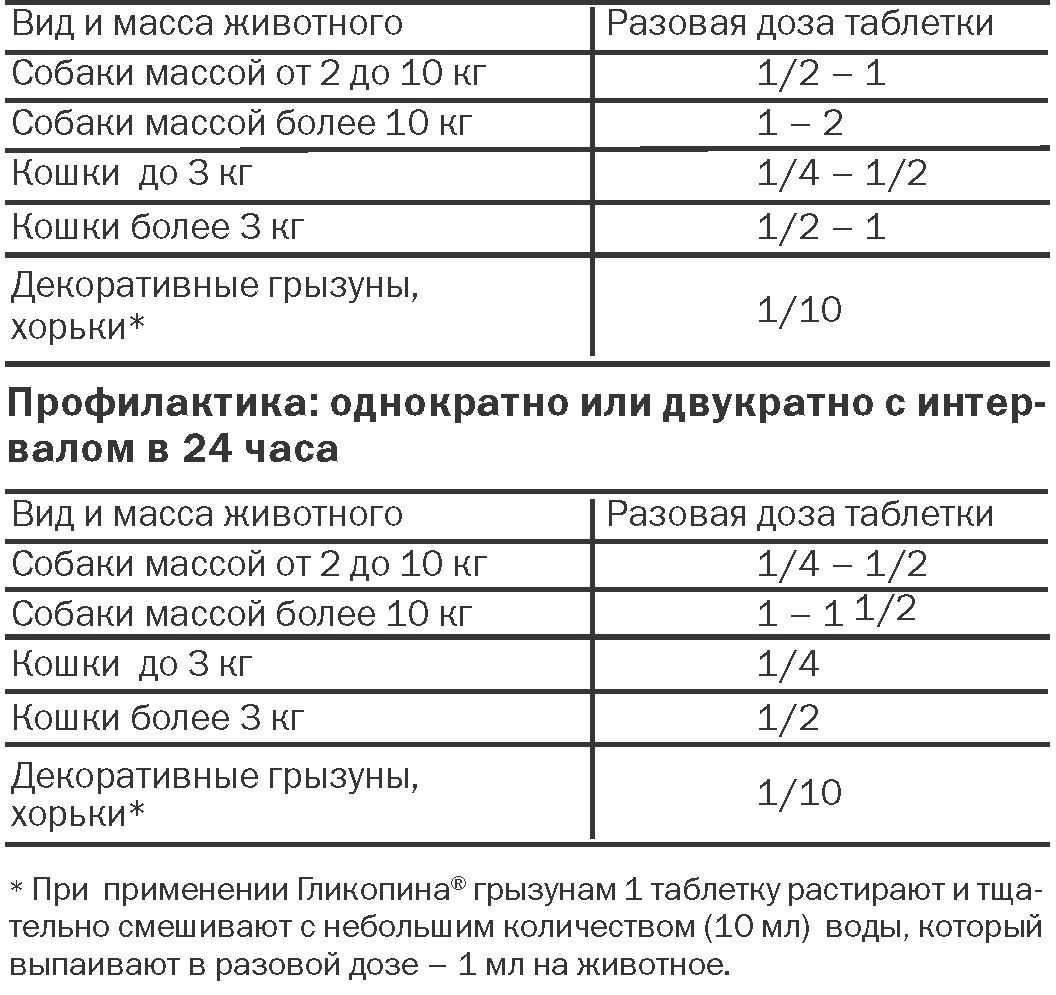
При пероральном введении Гликопина® в течение 28 дней ежедневно были установлены следующие дозы, не вызывающие каких-либо токсических проявлений: у кроликов – 1,0 мг/кг в день, у крыс – 0,5 мг/кг в день, у собак – 2,1 мг/кг в день.
В ходе экспериментов было установлено, что Гликопин® при пероральном и внутримышечном способе введения, в дозах в 50-100 раз превышающих терапевтическую, не оказывает токсического влияния на центральную нервную и сердечнососудистую системы, не вызывает побочных эффектов, не оказывает эмбриотоксического и тератогенного действия, не вызывает хромосомных, генных и геномных мутаций, не обладает местнораздражающим действием на кожу, слизистую оболочку полости рта и желудочно-кишечного тракта.
В соответствии с классификацией токсичности веществ, принятой в Российской Федерации (ГОСТ 12.1.007-76), препарат Гликопин® относится к IV классу опасности веществ - «мало опасные».
Практическое применение
В экспериментальных исследованиях показано, что Гликопин® является сильным активатором врожденной и адаптивной иммунной системы, что было подтверждено многочисленными клиническими испытаниями, проведенными почти на 100 тысячах мелких домашних, сельскохозяйственных животных и птице с различными хроническими инфекционно-воспалительными заболеваниями.
Кроме того, выявлены позитивные эффекты Гликопина® как адъюванта при вакцинации, для профилактики послеродовых осложнений и для усиления иммунитета ослабленных новорожденных.
В заключении необходимо отметить, что, по мнению многих ученых, в последние годы прикладная иммунология перешла от стадии интенсивных фундаментальных и эмпирических клинических исследований в область планового создания высокоэффективных и безопасных лекарственных препаратов на основе точного знания механизма их действия, одним из которых является лекарственное воздействие через рецепторы врожденного иммунитета.
Основные направления практического применения препарата Гликопин®
- профилактика и лечение заболеваний бактериальной и вирусной этиологии;
- заживление послеоперационных и гнойно-некротических ран;
- лечение грибковых и паразитарных кожных заболеваний;
- снятие поствакцинальных осложнений; повышение иммунитета беременных самок и получение от них физиологически здорового потомства, сокращение периода послеродовых воспалительных процессов в матке;
- профилактика снижения иммунитета при стрессовых состояниях у животных при транспортировках, на выставках и при различных обработках;
- в сочетанной противоопухолевой терапии.
Литература
1. В.А. Несмеянов. Глюкозамилмурамоилпептиды: на пути к пониманию молекулярного механизма биологической активности. Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАМН, Москва, 1998.
2. В.Т. Иванов, Т.М. Андронова, В.А. Несмеянов, Б.В. Пинегин, P. Ledger, R. Bomford, Р.М. Хаитов. Механизм действия и клиническая эффективность иммуномодулятора глюкозаминил-мурамилдипептида (Ликопида). Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАМН, Москва, 1997.
3. Б.В. Пинегин, Т.М. Андронова. Мурамилпептиды – иммунотропные средства нового поколения. Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАМН, Москва, 1999.
4. И.Г. Козлов, Т.М. Андронова. Лекарственные воздействия через рецепторы врожденного иммунитета. Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАМН, Москва, 2005.
5. Р. Бомфорд. Новые достижения в исследовании молекулярного механизма действия мурамилпептидов. Великобритания.
6. A.A. Karelin, E. Blishchenko, V.T. Ivanov. A novel system of peptidergic regulation. FEBS Lett. 1998.
7. Хаитов Р.М., Б.В. Пинегин, А.А. Бутаков, Т.М. Андронова, Е.Г. Буланова, В.А. Будагян. Иммунотерапия инфекционных послеоперационных осложнений с помощью нового иммуностимулятора Гликопина. Иммунология, 1994.
8. Чугунов А. О. Неизвестные пептиды. Наука и жизнь № 10, 2010.
9. Валякина Т.И., Малахов А.А., Макаров Е.А. и др. Мурамилпептиды модулируют экспрессию опухолеассоциированных антигенов. Институт биоорганической химии им. М.М.Шемякина РАМН, Москва; Онкологический научный центр РАМН, Москва Иммунология. № 4. 1993.
10. Терехова О.Б. Влияние Гликопина на фагоцитарную активность нейтрофильных гранулоцитов при пиодермиях у собак. Кубанский государственный аграрный университет, Краснодар, Россия. Russian Journal of Immunology. Volume 9. Supplement 4. 2007
11. Щуров И.В, Лысенко А.Г. Результаты клинического испытания препарата Гликопин у животных с вторичным иммунодефицитом. Центр биологии и ветеринарии РУДН.
12. Колесникова Н.В. Клинико-иммунологическая эффективность Гликопина в ветеринарии. Кубанский государственный аграрный университет, Краснодар, Россия. Современная ветеринарная медицина. № 2. 2011.
13. M.M. Shemyakin & Yu.A. Ovchinnikov. History of GMDP: from Mechnikov's Idea to Ligand of the NOD-2 Receptors. Institute of Bioorganic Chemistry of the RAS, Russian State Medical University, Federal Research and Clinical Centre of Pediatric Hematology, Oncology and Immunology. Moscow, Russia.

Назад в раздел

















