Диагностический подход и терапия при невоспалительной алопеции у кошек / Diagnostic approach and therapy of feline non-inflammatory alopecia
Еще фото
Автор (ы): А.Н. Герке, к.в.н., ветеринарный врач-дерматолог, член Европейского общества ветеринарных дерматологов (ESVD) / А. Gerke, DVM, PhD
Организация(и): ЗАО «Сеть ветеринарных клиник», Санкт-Петербург / «Network of veterinary clinics», St. Petersburg
Журнал: №5-6 - 2013
Ключевые слова: кошка, алопеция, аллергический дерматит, блохи, атопия, пищевая гиперчувствительность, дерматофитоз
Key words: cat, alopecia, allergic dermatitis, fleas, atopy, food sensitivity, dermatophytosis
УДК 619:616.5:636.7
Аннотация
Существует много причин развития алопеции у кошек. Большинство кошек с невоспалительной алопецией испытывает зуд в результате аллергии. Диагностический подход к кошкам с алопециями должен быть комплексным и включать следующие этапы дифференциальной диагностики: анализ данных анамнеза, тщательный клинический осмотр, проведение необходимых диагностических тестов, начиная с соскобов и микологического исследования (для исключения эктопаразитозов и дерматофитии). Для диагностики реакций гиперчувствительности применяются обработки от блох (с диагностической и лечебной целью) и исключающие диеты. Аллерготесты являются ненадёжным методом диагностики. Эндокринные алопеции редко встречаются у кошек, сопровождаются признаками системных нарушений. «Психогенная» алопеция является диагнозом исключения. Гистологическое исследование используется в редких случаях, когда «простые» методы диагностики и пробное лечение не дало результата.
Summary
Alopecia is a feline cutaneous reaction pattern that may have various causes. Most cats with non-inflammatory alopecia are pruritic as a result of allergies and may be closet groomers. The diagnostic approach to alopecia must be methodical, and should involve certain fundamental steps: a detailed history, thorough clinical examination, and carefully chosen diagnostic tests,selected according to the differential diagnosis. An initial range of tests (e.g. skin scrapings and mycological investigations) should he performed routinely, given the incidence of ectoparasitic infestation and dermatophytosis in the cat. Differential allergy diagnosis is based on avoidance measures (e.g. flea control and restricted diet) as allergy testing remains unreliable in this species. Hormonal alopecia is extremely rare in thefeline and typically affected cats show other severe signs. Psychogenic alopecia in the cat is greatly overdiagnosed. Skin biopsies are indicated when the history and clinical examination suggest a dermatosis that requires histological diagnosis.
Алопецией называется частичная или полная потеря шерсти. Алопеция — это симптом, который может быть связан с множеством нарушений в организме кошки, проявляться симметричной, очаговой или тотальной потерей / поредением шерстного покрова. По происхождению алопеции подразделяют на приобретённые и наследственные/врожденные.
Этиология алопеций у кошек
Наиболее частыми причинами алопеции кошек могут быть «самоиндуцированная алопеция», повреждение волос и волосяных фолликулов, воспалительные и / или инфекционные процессы, реже — нарушение роста шерсти, связанное с гормональными нарушениями и наследственными заболеваниями. Последние связаны с генетическими причинами, приводящими к нарушению формирования фолликулов или структурных белков, в связи с чем рост шерсти становится невозможным. К таким алопециям относятся эктодермальная дисплазия и фолликулярная дистрофия. Наследственный гипотрихоз встречается у корниш и девон рексов, бурмы, британских и сиамских кошек. Эти алопеции могут быть очаговыми или генерализованными. При гистопатологическом исследовании биоптатов выявляются мелкие, недоразвитые фолликулы первичных волос, небольшое количество фолликулов вторичных волос. Алопеция «ослабленного» (кремового или голубого) окраса связана с разрушением стержня волоса под воздействием аномальных гранул меланина. При Pili torti и Тrichorrhexis nodosa патологические изменения возникают в стержне волоса.
Другая группа болезней связана с поражениями волосяного фолликула, которые могут быть вызваны демодекозом, дерматофитозом, различными фолликулитами (перифолликулит при реакциях гиперчувствительности, кожных лекарственных реакциях, герпесвирусной инфекцией, муральный фолликулит при васкулопатии и др.). Тракционная алопеция (например, после колтунов) возникает вследствие отека, мононуклеарной инфильтрации кожи с последующим развитием фиброза и атрофии придатков кожи, поэтому в некоторых случаях шерстный покров в этом месте полностью не восстанавливается. Ограниченная невоспалительная алопеция у кошек может возникать в местах подкожных инъекций кортикостероидов, прогестагенов, а также после топикального нанесения противопаразитарных препаратов (селамектин, спинеторам) [6].
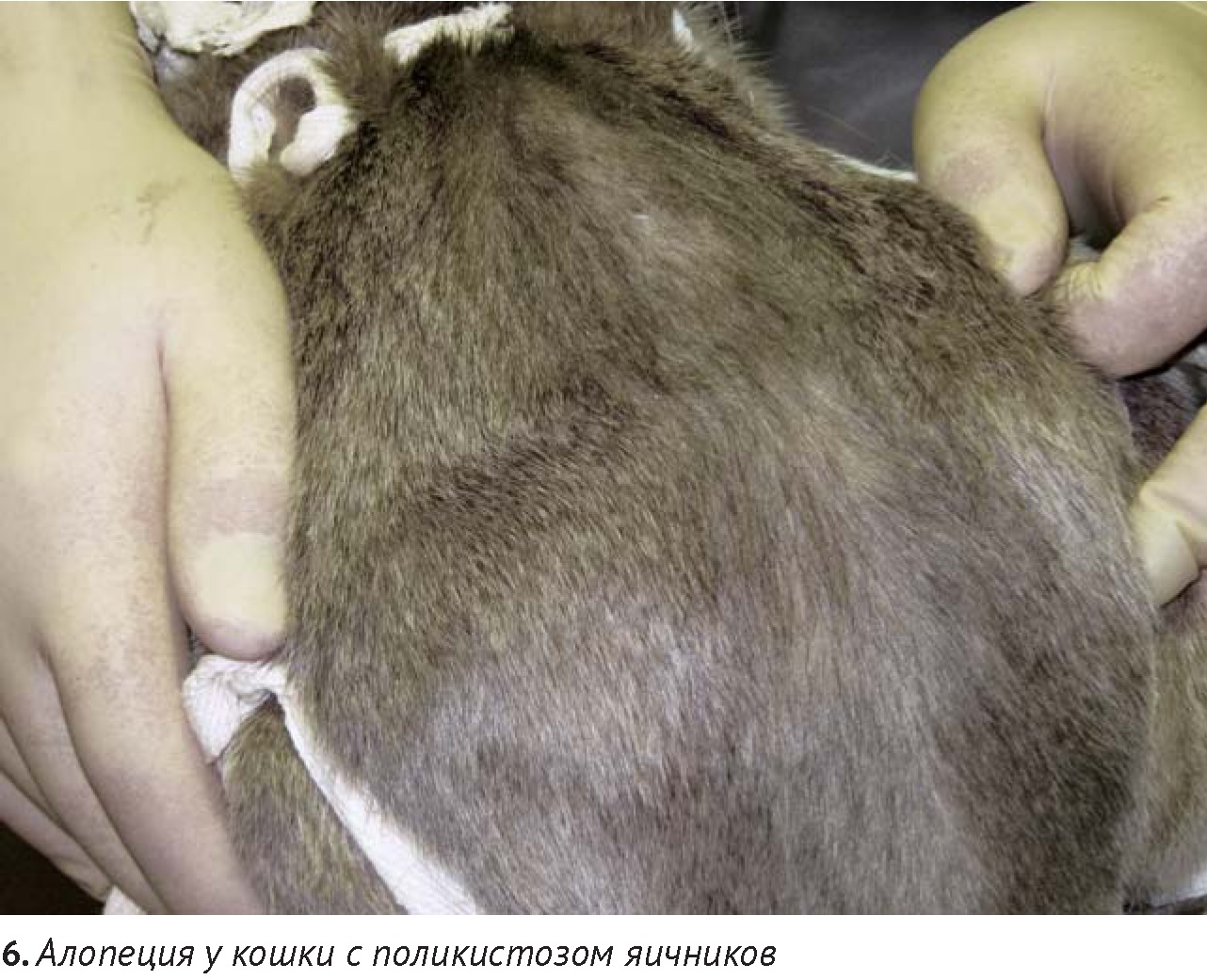
Эндокринные патологии у кошек в редких случаях приводят к алопеции в отличие от собак. К подобным алопециям, несвязанным с патологией фолликулов, приводят нарушения цикла волосяного фолликула (например, при системных болезнях – гиперадренокортицизме, гипертиреозе, диабете, редко, в отличие от собак, при гиперэстрогенизме). Синдром, сопровождающийся полиурией-полидипсией, потерей веса при полифагии у пожилых кошек может быть связан с гипертиреозом, при котором также может развиваться симметричная алопеция. Ятрогенный или спонтанный гиперадренокортицизм у кошек встречается редко. Он может приводить к таким дерматологическим нарушениям, как невоспалительная алопеция, атрофия, повышенная хрупкость кожи, кровоизлияния и закручивание кончиков ушей. В большинстве случаев синдрому Кушинга сопутствует сахарный диабет.
Изменения общего состояния с признаками нарушения пищеварительной системы, вызванными неоплазией поджелудочной железы и желчевыводящих путей, могут приводить к паранеопластическому синдрому, сопровождающемуся алопецией. При этом наблюдается прогрессирующая телогенизация и миниатюризация фолликулов с последующей атрофией, сопровождающейся легкой эпиляцией шерсти по всей поверхности кожи и алопецией, преимущественно, в области живота и конечностей. Кожа пораженных участков приобретает глянцевый блеск. Паранеопластическая алопеция встречается в основном у старых кошек с прогрессирующей потерей веса и летаргией в анамнезе. В этом случае появлению алопеции предшествуют признаки желудочно-кишечных нарушений (анорексия, рвота и т.п.).
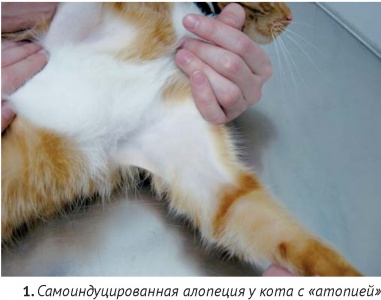
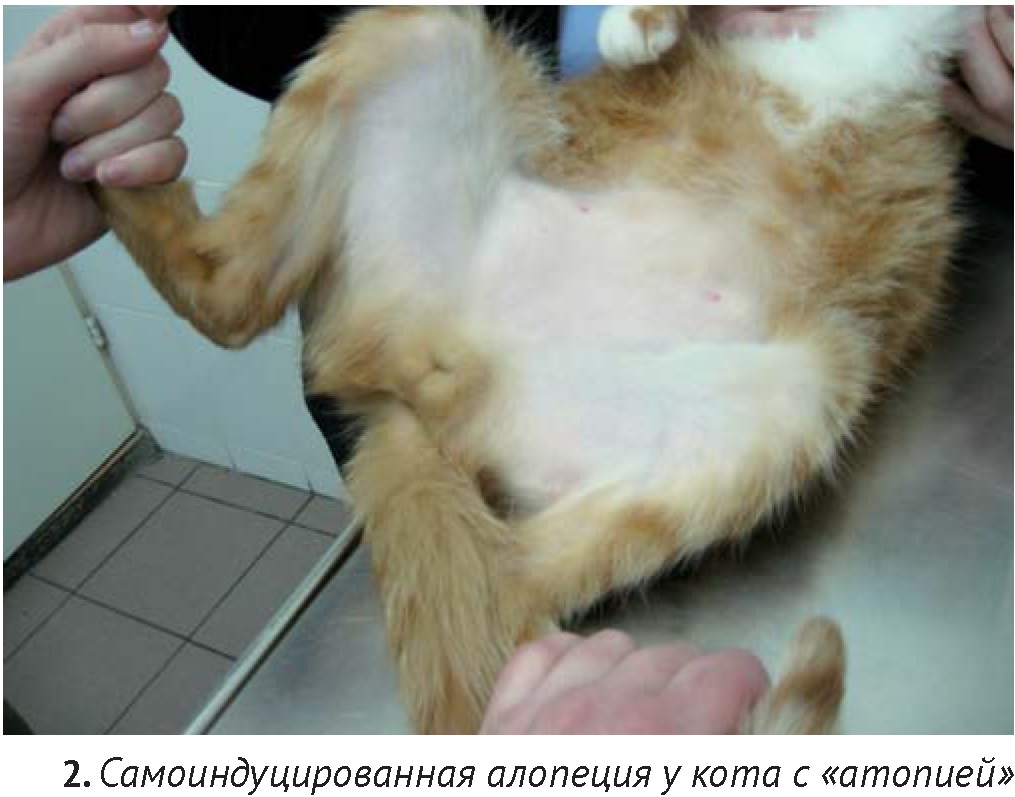
Наиболее частый вид алопеции – самоиндуцированная, которая связана с чрезмерным вылизыванием. Диагностический подход не отличается от тех случаев, когда основной жалобой владельца является зуд у кошки, несмотря на то, что во многих случаях самоиндуцированной алопеции владельцы «спонтанно лысеющих» кошек отрицают наличие зуда у их питомца. В исследовании, проведенном Stefan Hobi с соавторами из 502 кошек зуд и алопеция был вызван гиперчувствительностью к укусам блох у 29%, пищевыми факторами у 12%, другими аллергенами у 20%, прочими болезнями неаллергической этиологии – 24% [20]. Нет никаких клинических критериев, по которым можно однозначно выяснить причину гиперчувствительности. Однако, фактом, известным в течение долгого времени, остается, то, что алопеция в области спины, как правило, связана с укусами блох или хейлетиеллезом [14]. Наличие повреждений более, чем на одной части тела, увеличивает вероятность непищевой и непаразитарной причины. Одновременное присутствие симметричной алопеции, милиарного дерматита, эрозий и язв в области головы и шеи, скорее связано с «атопическим дерматитом». Наличие милиарного дерматита, особенно, локализованного не дорсально, также часто связано с «атопией» [13]. Заключение о поведенческих нарушениях (так называемой «психогенной алопеции») можно сделать только после исключения других возможных причин.
Дифференциальная диагностика
Исключение эктопаразитов, трихоскопия и микроскопия соскобов
Первым этапом диагностики является исключение эктопаразитозов, что включает обработки от блох (с диагностической и лечебной целью), трихоскопию и исследование кожных соскобов для выявления других кожных паразитов.
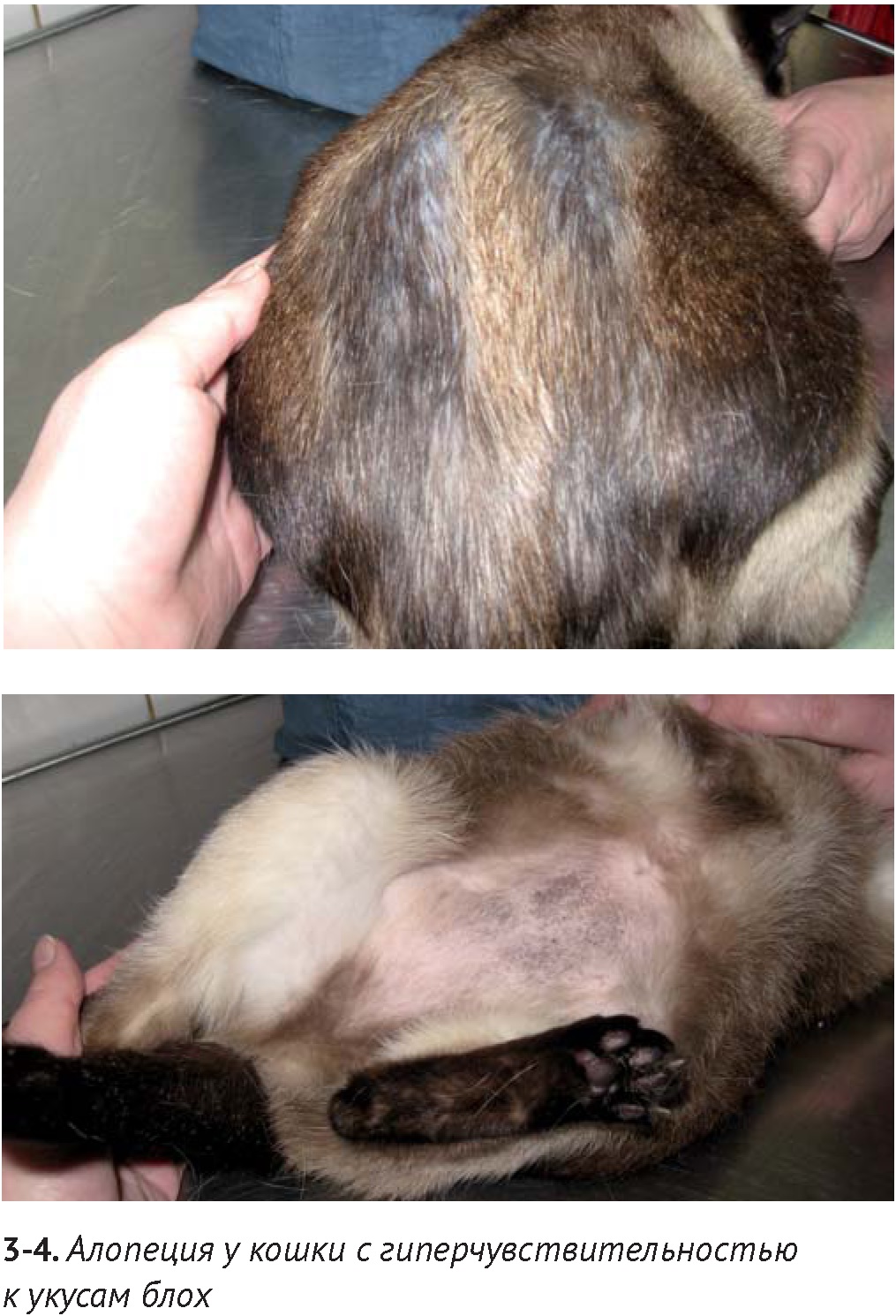
Блошиный аллергический дерматит (БАД) является наиболее частой причиной дерматозов, сопровождающихся зудом у кошек. Отсутствие блох и их фекалий на кожном покрове кошки не исключает наличие гиперчувствительности к укусам блох, поскольку кошки с БАД усиленно вылизываются и удаляют их с кожи. Характерным признаком БАД является самоиндуцированная алопеция, главным образом, в области спины и поясницы. Кроме этого, у многих кошек с БАД можно обнаружить признаки милиарного дерматита, а иногда — эозинофильные бляшки и линейные гранулёмы.
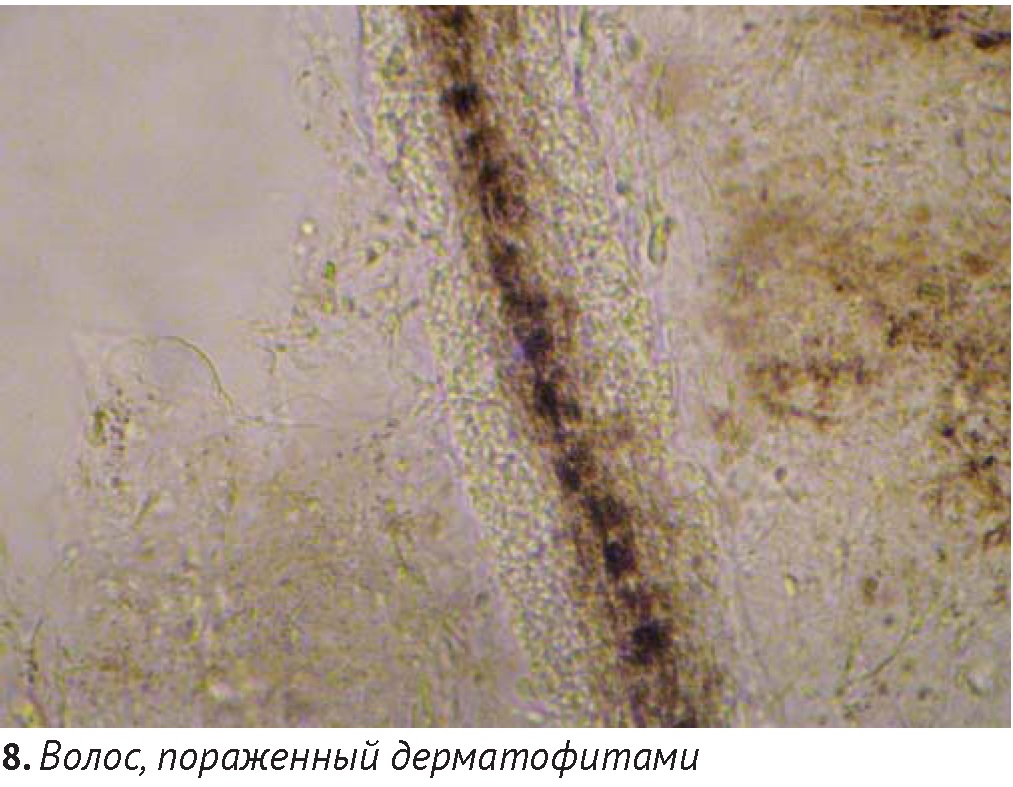
Во всех случаях алопеции у кошек первым рекомендуемым тестом является трихоскопия, дающая возможность оценить структурные изменения волоса, включая корень, стержень и кончики. Для этого при помощи хирургического зажима выщипывают 20 – 30 волосков, которые помещают на предметное стекло с предварительно нанесенной каплей жидкого парафина или глицерина, накрывают покровным материалом и проводят микроскопию, используя объективы х4 и х20. Это исследование позволяет оценить преобладающие стадии цикла волосяного фолликула (анаген, телоген), выявить повреждения кончиков (при самоиндуцированной алопеции) и стержней волос (дерматофитоз, различных изменениях кутикулы, например, Pili torti, фолликулярная дисплазия и Тrichorrhexis nodosa).
Алопеция в стадии телогена развивается через 4-12 недель после стресса, например, тяжелой болезни, лихорадки, шока, хирургического вмешательства и т.п. в этих случаях преждевременное прекращение стадии анагена приводит к синхронизации фолликулов в катагене, а затем в телогене. Рост шерсти в этом случае возобновится со следующей линькой.
Для выявления клещей, обитающих на поверхности кожи, можно использовать быстрый и простой скотч-тест. Например, при помощи этого метода можно обнаружить взрослые особи Cheyletiella blakei, а также их яйца, прикрепленные к стержню волоса. Однако чувствительность скотч-теста достаточно низка, поэтому для лучшего результата целесообразно проводить исследование материала, полученного путем вычесывания при помощи щетки.
Для диагностики эктопаразитозов и трихофитии также можно исследовать поверхностные соскобы с кожи. Для этого лезвием скальпеля соскабливают кожный дебрис (эпидермис, шерсть, чешуйки и т.д.), располагая лезвие перпендикулярно поверхности кожи.
Для качественного получения материала на лезвие скальпеля предварительно наносят каплю жидкого парафина. Скарификат наносят на предметное стекло и проводят микроскопию. Таким методом можно обнаружить таких паразитов, как Cheyletiella blakei, Otodectes cynotis, Notoedres cati, Demodex cati и Demodex gatoi, а также дермато-фиты [13, 20, 42].
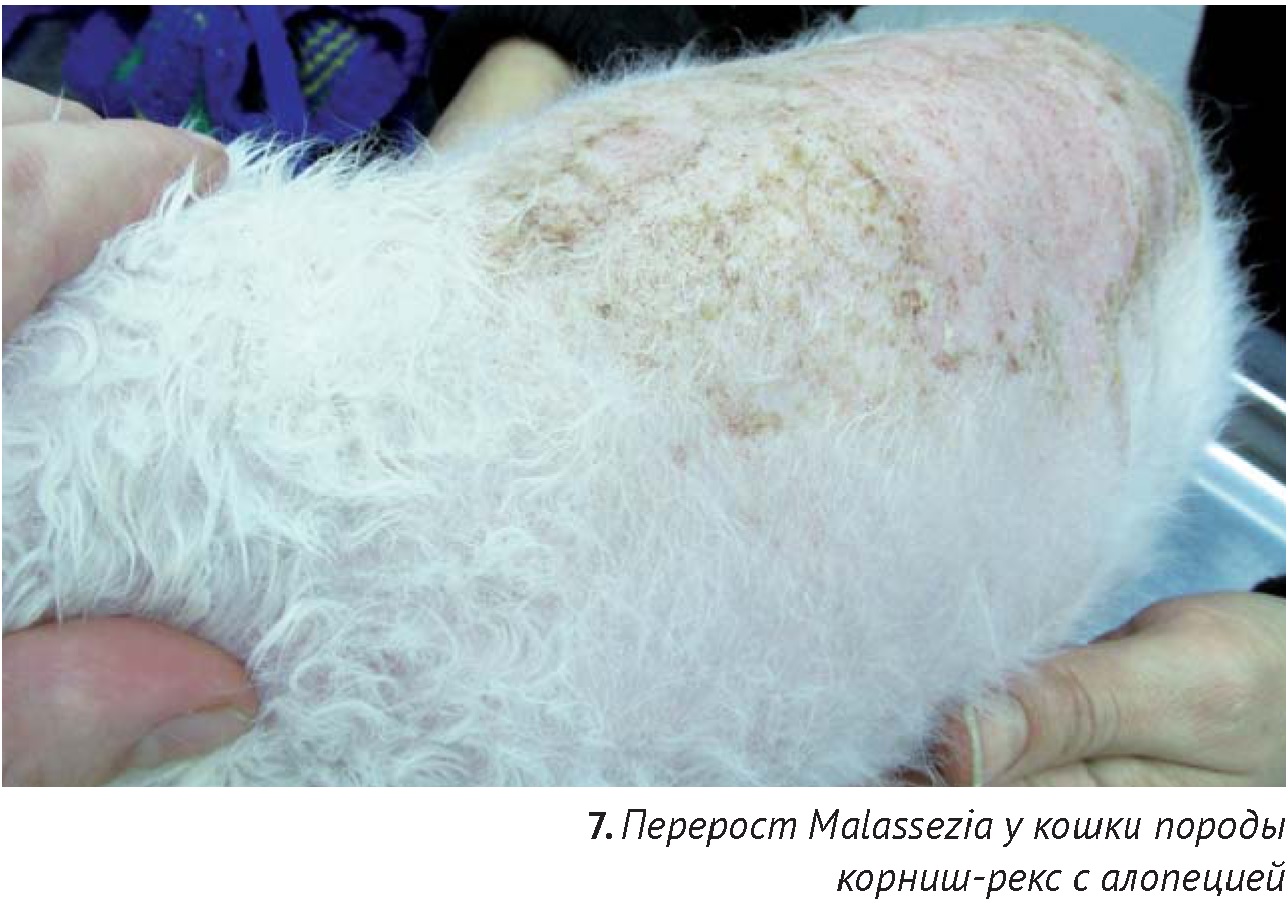
Silbermayr K. с соавторами (2013) предлагает также использовать копроскопию для диагностики инвазии Demodex gatoi. Для флотации использовали насыщенный раствор сахара и цинка сульфата. В данном исследовании клещи Demodex были обнаружены в фекалиях как у кошки породы корниш рекс с алопецией, так и у тайской кошки, находящейся в контакте и не имеющей никаких признаков кожных поражений. Обнаружение клещей Demodex в фекалиях связано с тем, что кошки заглатывают клещей при вылизывании. Благодаря хитиновому покрову, клещи не подвергаются воздействию пищеварительных ферментов и выходят с фекалиями [38].
До недавнего времени считалось, что на коже кошек можно обнаружить Demodex cati (преимущественно в слуховом канале) и Demodex gatoi. Однако последними исследованиями методом ПЦР установлено, что и D. canis изредка может паразитировать на коже кошек [12, 21].
При наличии участков воспаленной кожи, милиарного дерматита рекомендуется проведение цитологического исследования, оно может быть полезным при диагностике аллергического дерматита, а также позволяет выявить дерматофитов и Malassezia.
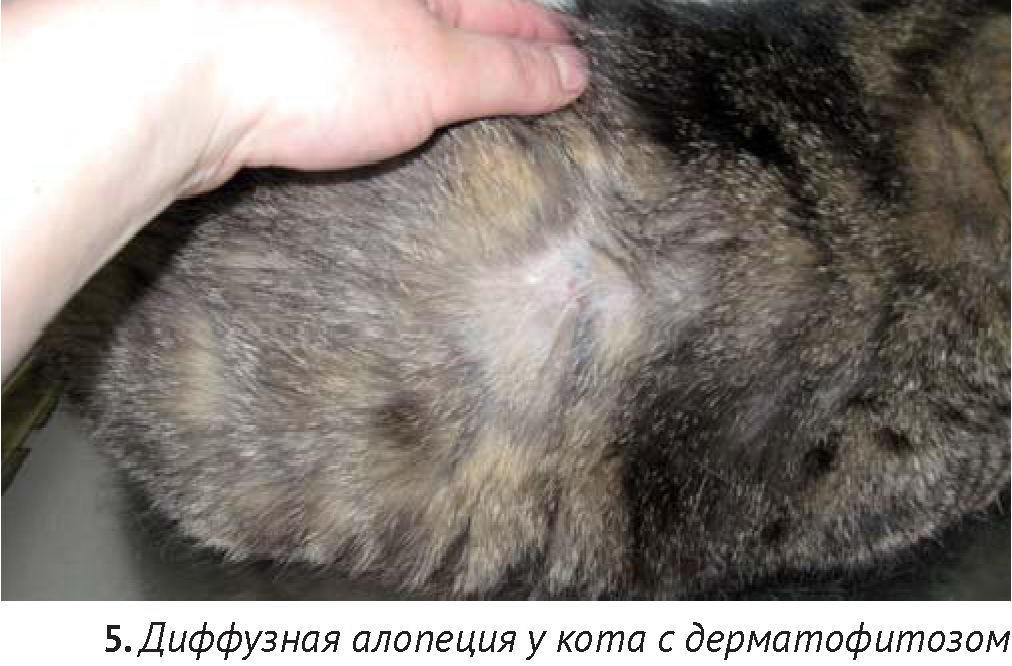
Поскольку дерматомикозы могут быть причиной как очаговой, так и тотальной или диффузной алопеции, у всех кошек с алопецией грибковые инфекции должны быть исключены [13, 20, 42].
К методам прямой визуализации микозов относятся: оценка клинических признаков, включая осмотр в лучах лампы Вуда, трихоскопия, цитологическое исследование. Несомненными плюсами этих методов является простота, скорость, низкая стоимость. Однако отрицательными качествами их являются низкая чувствительность, отсутствие специфической идентификации, сложности интерпретации в случаях оппортунистических микозов. Поэтому, чтобы установить и идентифицировать грибковые инфекции у кошек, рекомендуется комбинировать несколько методов.
Рутинный подход ко всем случаям алопеции у кошек включает осмотр в лучах лампы Вуда. Принцип метода заключается в обнаружении зелёной флюоресценции в ультрафиолетовом свете, характерной для птеридина, пигмента, содержащегося в гифах Microsporum canis. Осмотр проводят в затемненном помещении, предварительно прогрев лампу в течение 3-5 минут. Эта процедура позволяет выявить до 50% случаев микроспории. Ложное свечение (голубоватое, желтоватое и др.) может быть вызвано лекарственными препаратами, бактериями и др.
Новым методом экспресс-диагностики является дерматоскопия с помощью дерматоскопа, некоторое время уже используемого в гуманной дерматологии. Так, при дерматоскопическом исследовании, используя 10-кратное увеличение, при инфекции, вызванной Microsporum canis, были обнаружены поврежденные волоски, покрытые остроконечными чешуйками одинаковой толщины, бело-желтого цвета, «сального» вида. При проведении микроскопии этих волос, были обнаружены гифы и споры вдоль стержня волоса [35].
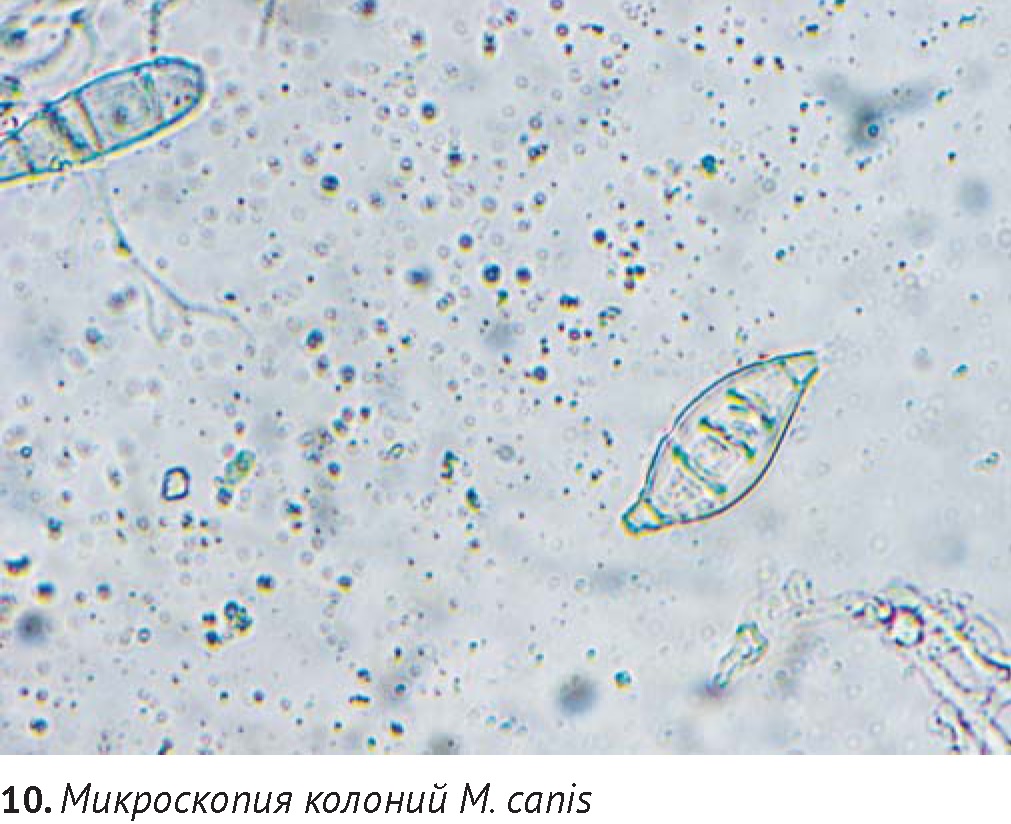
Для трихоскопии и получения культуры дерматофитов предпочтительнее выбирать волоски, флуоресцирующие в лучах лампы Вуда (при выявлении таковых). Прямая микроскопия волос и чешуек позволяет обнаружить гифы и споры дерматофитов (диаметром 3-12 мкм), однако видовую принадлежность их можно установить только путем получения культуры на питательных средах.
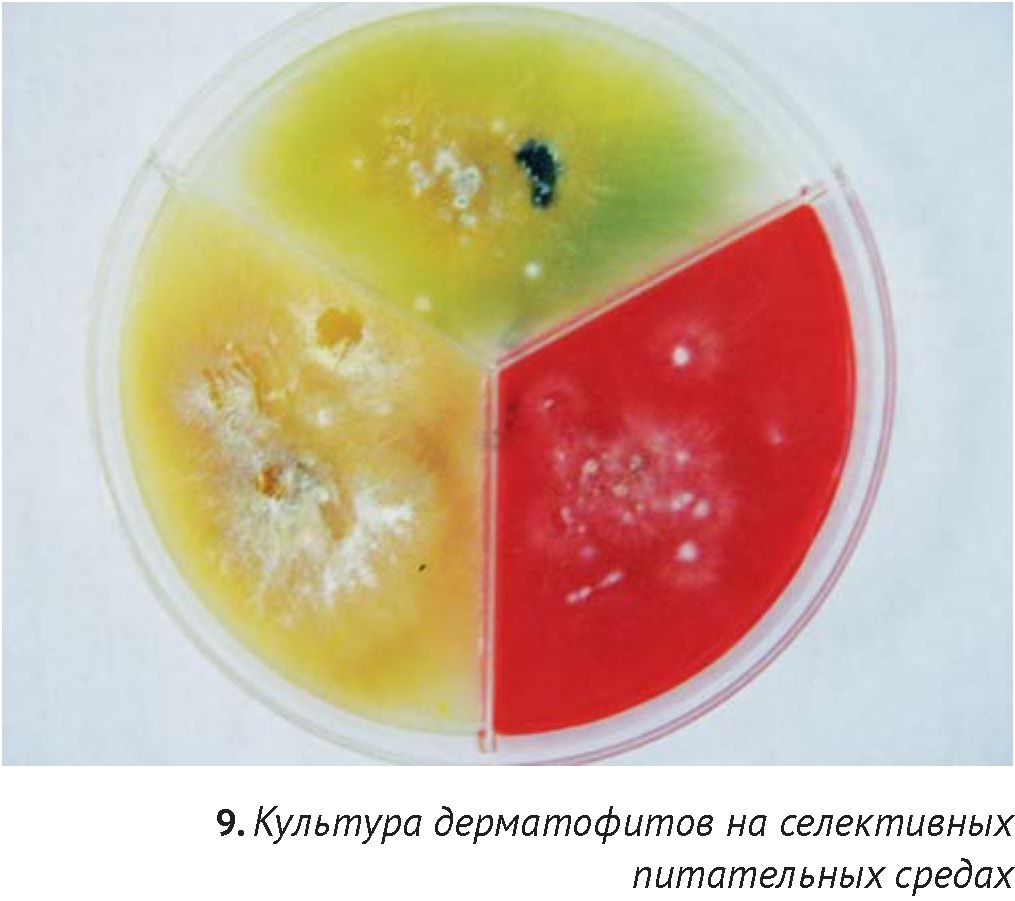
Для культивирования используют как селективные среды (Сабуро с добавкой для дерматофитов, Dermatophyte Test Medium (DTM)), так и неселективные, например агар Сабуро. Перед взятием материала кожу обрабатывают тампоном, смоченным спиртом, в течение 30 секунд для устранения загрязнения образца непатогенной флорой. Для посевов используют шерсть и чешуйки с пораженных областей (при очаговом поражении материал берется из центра и с краев), для подтверждения микологического выздоровления – материал вычесывается при помощи щетки. Получение культуры дерматофитов подразумевает макроскопическое и микроскопическое исследование колоний. При росте дерматофитов на селективной среде DTM, содержащей цветной индикатор, среда приобретает красное окрашивание, связанное с влиянием щелочных метаболитов растущими колониями дерматофитов. Обычно для этого требуется 3-10 дней (при температуре 25-270С). Более позднее изменение цвета среды (через 2-4 недели) наблюдается под воздействием роста сапрофитных грибов (например, Aspergillus spp. и Mucor spp.) и бактерий, что может быть причиной ложноположительного результата. Исключение составляет вид Microsporum persicolor, не дающий изменение окраски (ложноотрицательный результат). В связи с этим автор рекомендует обязательное проведение микроскопии полученных колоний для получения точного диагноза, вне зависимости от типа используемой питательной среды.
Получение культуры позволяет установить точный диагноз, является единственным методом, подтверждающим микологическое выздоровление после проведения курса лечения. При помощи культуральных исследований возможно диагностировать различные микозы — это высокоспецифичные методы, позволяющие, в некоторых случаях, определить чувствительность к антимикотикам. Однако работа с культурами грибов требует навыков, представляет собой риск контаминации и может быть опасной для здоровья. Эти методы достаточно дороги и требуют времени (на получение зрелой культуры может потребоваться до двух-трех недель), также существуют определенные сложности с грибами-оппортунистами [18].
Высокочувствительным и специфичным методом подтверждения микозов является выявление антигенов грибов в тканях методом иммуногистохимии, что позволяет провести количественную оценку, однако требует значительных финансовых затрат и специального оборудования. Другую группу точных исследований составляют методы, позволяющие оценить ответ хозяина (специфические антитела, использование биомаркеров, анализ клеточной реакции в гистопрепаратах) – высокочувствительные и специфичные, с возможностью количественной оценки, но требующие специальной лаборатории, некоторые методы видоспецифичны и неприменимы при острых формах болезни. Поэтому эта группа исследований используется только в специализированных исследовательских лабораториях [18].
Другим грибом, встречающимся на коже кошек с алопецией, является Malassezia. Грибы рода Malassezia –это липофильные дрожжи (размером 2-8 мкм), в некотором количестве присутствующие на коже всех теплокровных животных, являющиеся оппортунистическими патогенами. M. рachydermatis, M. sympodialis, M. globosa обнаруживаются как на коже здоровых кошек, так и при кожных поражениях (причем, 2 последних, преимущественно, при отитах у кошек). M. рachydermatis не является липидзависимым, т.е., хорошо растет на среде Сабуро даже без добавления липидов, для культивирования других видов Malassezia, которые являются липидзависимыми, используют модифицированную среду Диксона и другие липидсодержащие среды (для ингибирования роста бактерий используется 0,05% хлорамфеникол и 0,05% циклогексимид).
Малассезиозный перерост у кошек встречаются значительно реже, чем у собак. В литературе есть данные о малассезиозном переросте кошек, подтвержденным цитологическими и культуральными исследованиями (M. рachydermatis). Клиническими признаками были алопеции и зуд, а также появление эритемы и корочек [7]. У кошек пород девон-рекс и корниш-рекс имеется породная предрасположенность к Malassezia-переросту. Генерализованные поражения (за исключением слухового канала, межпальцевых складок и морды), вызванные переростом Malassezia у кошек, как правило, являются осложнением первичных системных болезней, имеющих плохой прогноз, например, фолликулярной атрофии на фоне паранеопластического синдрома (карцинома поджелудочной железы или гепатобилиарной системы и т.д.). Таким образом, обнаружение перероста грибов Malassezia при цитологическом исследовании у кошек подразумевает необходимость поиска первичной причины. В большинстве случаев контроль малассезиозного перероста у кошек предполагает пожизненную терапию тех болезней, которые к нему привели, иначе вероятен рецидив кожных проблем [17].
После исключения эктопаразитозов и грибковых инфекций, проводится диагностика гиперчувствительности, включая элиминационные диеты и, в некоторых случаях, проведение специфических аллерготестов.
РЕАКЦИИ ГИПЕРЧУВСТВИТЕЛЬНОСТИ
Реакции гиперчувствительности являются наиболее частой причиной кожных болезней кошек, включая гиперчувствительность к укусам блох (реже других насекомых), реакции пищевой гиперчувствительности, уртикария, контактный дерматит и атопический дерматит [37].
По данным исследований, проведенным в различных географических областях, соотношение разных диагнозов значительно варьирует, однако лидирующее место в списке причин гиперчувствительности у кошек занимают укусы блох. Иммунопатогенезу гиперчувствительности к укусам блох посвящено большое количество исследований. В целом, слюна блохи Ctenocephalides felis felis содержит множество высокомолекулярных протеинов, вызывающих как аллергические реакции I типа и дегрануляцию тучных клеток, так и аллергические реакции замедленного типа. По-видимому, в связи с реакциями немедленного типа, при цитологическом / гистологическом исследовании участков кожи, подверженных самоиндуцированной алопеции вследствие БАД, было выявлено увеличение количества тучных клеток, по сравнению с интактными участками кожи. Диагностика БАД путём проведения внутрикожных тестов с различными видами экстрактов Ctenocephalides felis felis не принесла ожидаемого результата многим исследователям, поскольку из-за нестабильной антигенности возникают проблемы воспроизводимости исследований. Такая же неудача постигла и серологические тесты, поскольку многие здоровые кошки без признаков зуда показывали результаты, аналогичные с кошками с БАД [25]. Критерии диагностики реакций гиперчувствительности к укусам блох у кошек, описанные в исследовании Favrot C. с соавторами (2012), включают исчезновение признаков зуда у кошек на фоне строгого контроля блошиной инвазии и возобновление зуда при прекращении обработок. По данным этого исследования, 137 из 238 кошек с признаками алопеции страдали от гиперчувствительности к укусам блох. В недавнем исследовании, посвященном выявлению областей, наиболее подверженных зуду и появлению алопеции при гиперчувствительности к укусам блох, установлено, что признаки зуда наблюдаются у 95,9% этих кошек, в том числе только усиленное вылизывание — у 42,3%. Наиболее часто алопеция проявлялась на спине (43,6%), пояснице и хвосте (26,2%), животе (26,8%), реже на других участках тела [3]. По данным C. Favrot, проявление алопеции на дорсальной и боковой поверхности тела характерно для гиперчувствительности к укусам блох, в то время как алопеция, сопровождающаяся повреждениями в области головы и шеи, чаще связана с пищевыми реакциями и аэроаллергенами [10]. Когда исключены гиперчувствительность к укусам блох и пищевая аллергия путем проведения регулярных обработок и пробного кормления элиминационными диетами на протяжении 8 – 12 недель, а признаки зуда все еще не устраняются, возможно проведение аллерготестов для выявления реакции на аэроаллергены.
Термин «атопический дерматит», в отношении кошек не совсем точен, поскольку роль IgE в развитии этих болезней у них окончательно не доказана. Однако под этим диагнозом подразумевают зудящие дерматозы, как правило, сопровождающиеся эозинофилией, несвязанные с паразитозами и пищевыми реакциями, отвечающие на иммуносупрессивную терапию [8, 10, 11, 13, 20, 29].
Кошки с явлениями гиперчувствительности могут иметь сопутствующие недерматологические симптомы. В одном из исследований у 6% кошек с кожными проявлениями аллергии наблюдались также респираторные симптомы (чихание, покашливание), у 14% — признаки нарушения пищеварения (диарея, рвота), у 7% — конъюнктивит, у 16% — наружный или средний отит [5, 8, 10, 11, 13, 20, 29].
Исследования Rossi M.A. (2013) показали более высокую эффективность накожных тестов по сравнению с внутрикожными инъекциями при реакциях гиперчувствительности у кошек [33].
Кроме того, дополнительными диагностическими процедурами, необходимыми для постановки диагноза и оценки прогноза, могут быть исследования анализов крови (гематология, биохимия, эндокринологические исследования), позволяющие выявить системные нарушения. Эозинофилия в крови может наблюдаться при многих болезнях кошек, часто связана с гиперчувствительностью к укусам блох и другими аллергиями. Однако, при остро возникшей реакции, эозинофильная инфильтрация кожи за счет миграции эозинофилов как клеток-эффекторов аллергической реакции может не сопровождаться эозинофилией в анализах крови. Напротив, присутствие эозинофилии в крови на фоне противоаллергической терапии свидетельствует о неэффективности данной лечебной тактики.
Редкие случаи, когда только гистологическое исследование позволяет провести точную диагностику, включают очаговую алопецию, атрофическую алопецию (псевдопелада) и др. Для получения биоптатов используют эксцизионную биопсию (хирургическое иссечение образца кожи) или панч-биопсию (обычно используются панчи диаметром 6 и 8 мм). Биоптат фиксируют 10% формалином. Исследование биоптатов кожи должен проводить гистопатолог, имеющий опыт работы в ветеринарной дерматологии.
Методы визуальной диагностики (рентген, УЗИ, КТ и другие) могут быть использованы при подозрении на панкреатическую паранеопластическую алопецию [29].
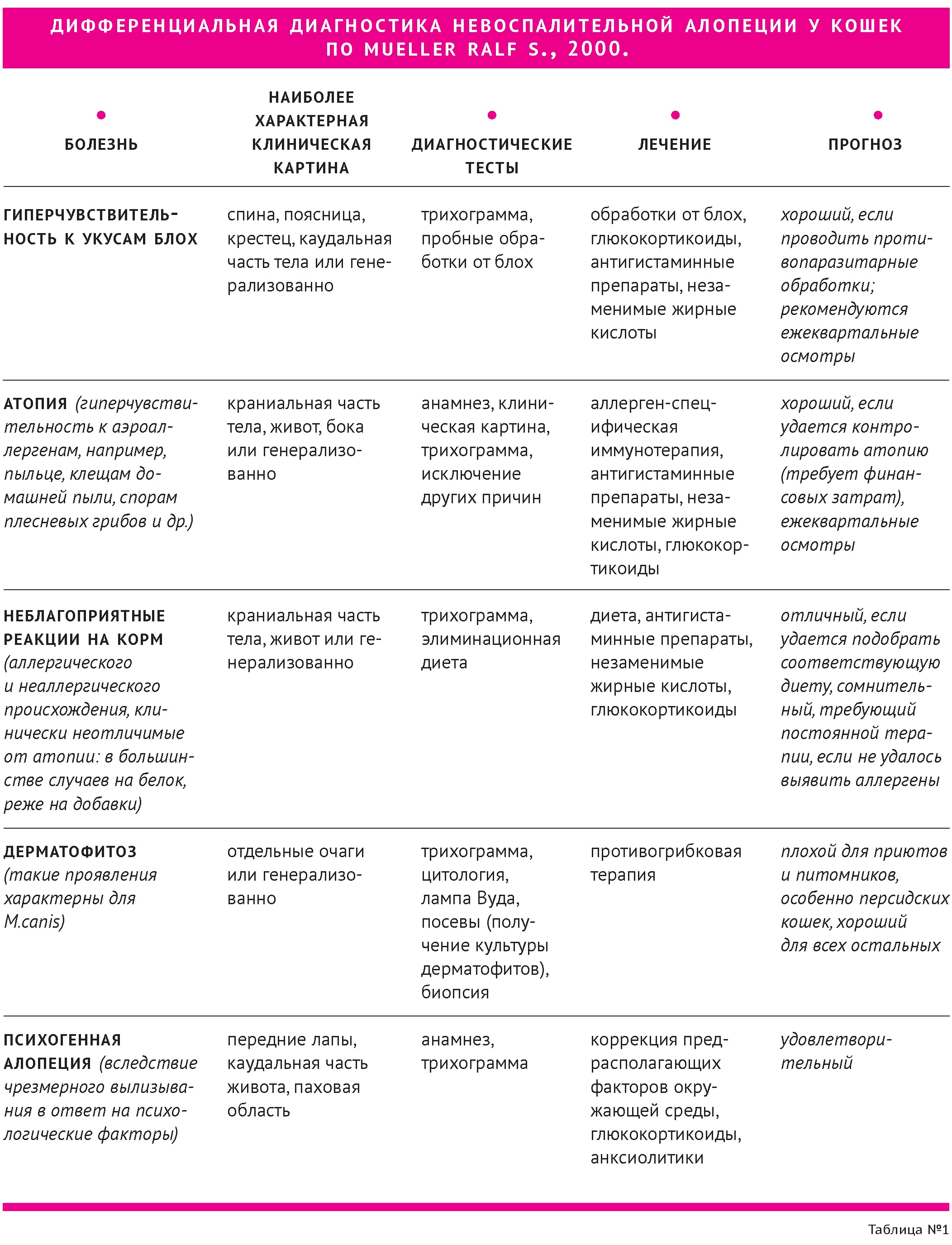
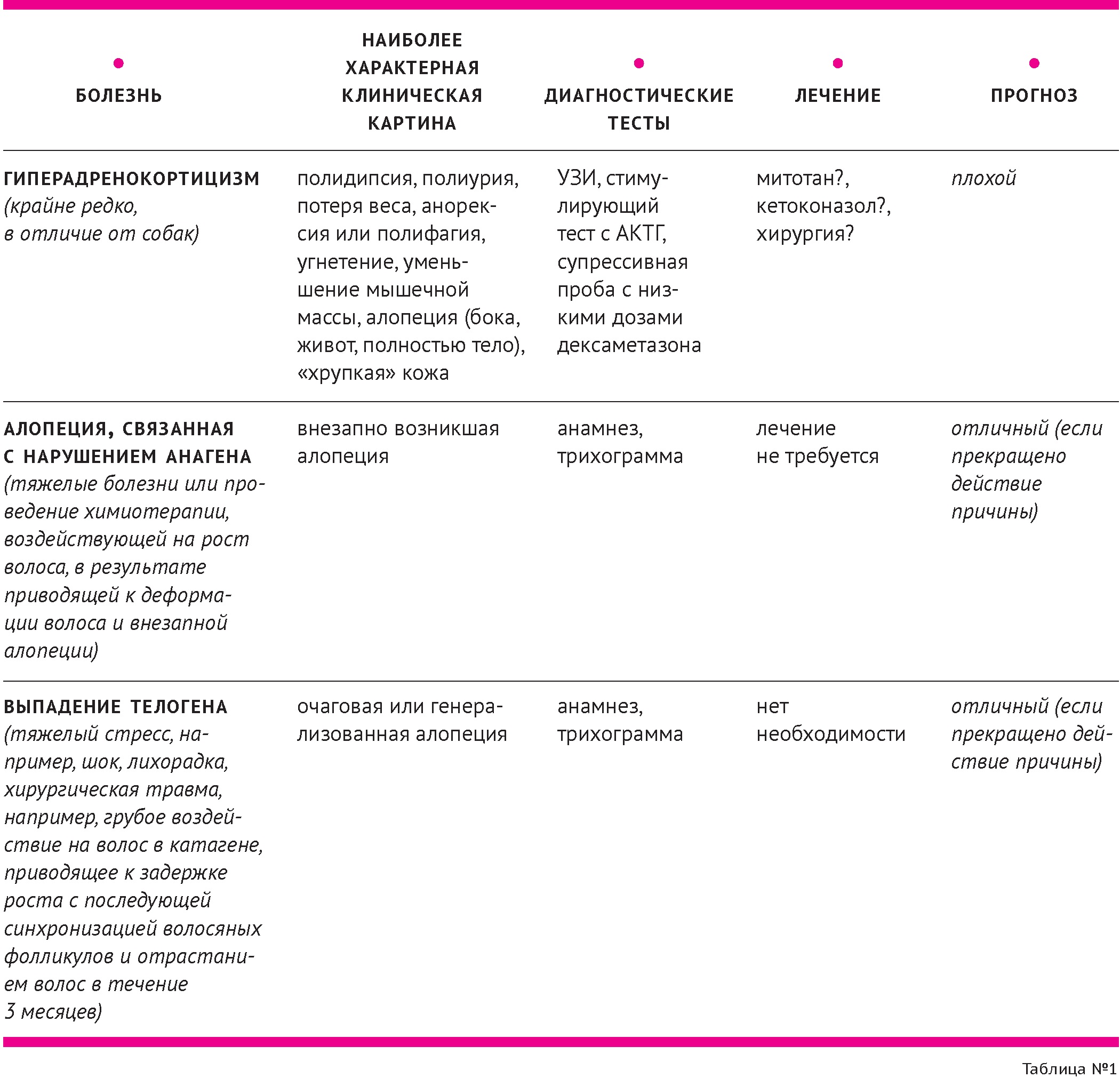
Дифференциальная диагностика невоспалительной алопеции у кошек представлена в
ЛЕЧЕНИЕ
ПРОТИВОПАРАЗИТАРНЫЕ ПРЕПАРАТЫ
Большинству кошек, испытывающих зуд, необходим строгий контроль над блошиной инвазией (в качестве основного или вспомогательного средства терапии и / или диагностики). В одном объективном исследовании по изучению спиносада (Comfortis®, Elanco Companion Animal Health, UK), в котором участвовало 46 кошек с алопецией (из них лишь у 27% были обнаружены блохи и их фекалии), подтверждено, что надежная защита от укусов блох оказывает быстрое и долговременное действие. Препарат применяли ежемесячно в дозе 1 (270 мг) или УУ таблетки (в зависимости от размера кошки) на протяжении 7 месяцев. Все животные переносили препарат хорошо (кошки съедали таблетки добровольно или в раскрошенном виде с едой), однако у некоторых животных наблюдалась однократная рвота (у трех животных только при первом получении препарата). У всех кошек, участвующих в опыте, наблюдалось полное восстановление шерстного покрова без дополнительной терапии [3].
Основной проблемой при лечении кошек с гиперчувствительностью к укусам блох, является несоблюдение владельцем режима противопаразитарных обработок. Выбор правильного протокола и обучение владельца, что требует определенных усилий и затрат времени, значительно увеличит процент успешно вылеченных животных. В любом случае, первый раз противопаразитарная обработка должна проводиться в ветеринарной клинике, чтобы продемонстрировать владельцу правильное применение препаратов. Другой проблемой может быть резистентность, которая может возникать у насекомых, в частности блох, к продуктам, используемым для борьбы с ними. Однако существуют пути преодоления развития резистентности у блох. Одной из возможностей является комбинирование нескольких продуктов одновременно. Этот подход становится все более популярным в мире. Другой подход заключается в смене препарата при появлении признаков резистентности у насекомых, чтобы уничтожить резистентных блох новым эффективным продуктом, не допуская размножения их в большом количестве, выжидая срок окончания действия неэффективного препарата. Для успешной борьбы с эктопаразитами необходимо также обрабатывать всех животных, находящихся в контакте, даже если зуд и другие клинические признаки у них отсутствуют. Обработки окружающей среды необходимы при лечении аллергического блошиного дерматита, и, возможно, хейлетиеллеза [25].
Mueller Ralf S. (2000) [25] в известном руководстве рекомендует следующую тактику проведения противопаразитарных обработок:
— Подозрение на гиперчувствительность к укусам блох: агрессивный контроль над блошиной инвазией необходим на протяжении от 4 до 6 недель. Устранение признаков болезни после обработки подтверждает диагноз, в этих случаях рекомендуется применение адультицидов совместно с регуляторами роста насекомых для обезвреживания окружающей среды.
— Доказанная гиперчувствительность к укусам блох: в идеале рекомендуется постоянное использование ингибиторов роста насекомых, проведение дезинсекции окружающей среды и применение адультицидов (системно, топикально). Альтернативой является использование только адультицидов, меняя препарат при первых признаках резистентности, либо уменьшая интервал между обработками. Зачастую неэффективность контроля блошиной инвазии связана с нарушением режима обработок, а не развитием резистентности у блох.
— Отсутствие гиперчувствительности к укусам блох: Мюллер не рекомендует проводить регулярные обработки таким животным, за исключением тех случаев, когда владелец сам желает этого. Если клиент хочет начать работу по уничтожению блох, вариантом выбора будут регуляторы роста насекомых.
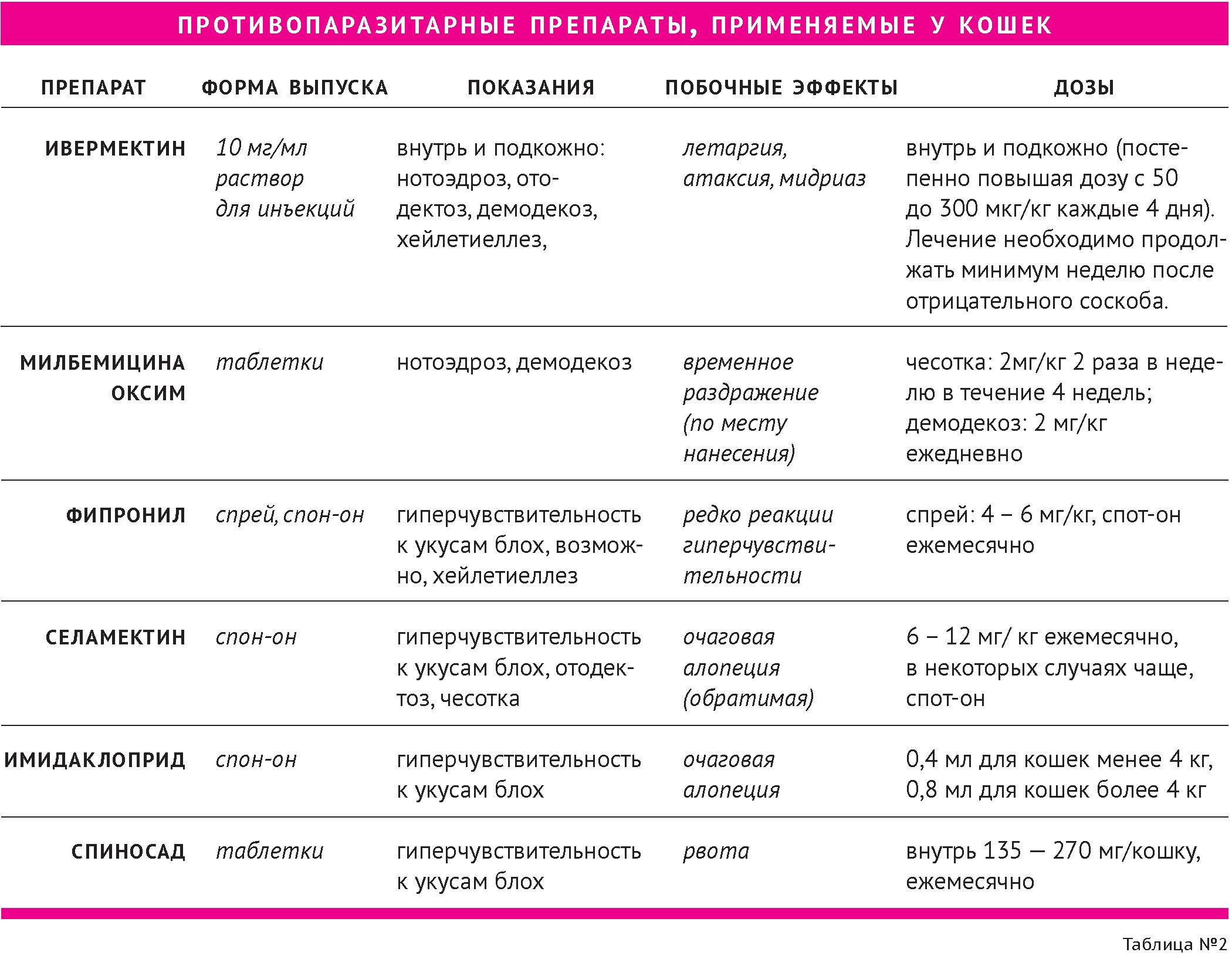
Наиболее часто используемые у кошек противопаразитарные препараты приведены в таблице 2.
Для лечения демодекоза, вызванного Demodex gatoi, Silbermayr K. с соавторами применяли орально инъекционную форму ивермектина в дозе 250 мг/кг через день в течение трех месяцев (до получения отрицательных результатов соскобов или копроскопии). Никаких побочных явлений выявлено не было. Тем не менее, имеется сообщение, что через четыре месяца у одной кошки лечение ивермектином пришлось остановить в связи с появлением атаксии и отказом от корма [38].
ПРОТИВОГРИБКОВАЯ ТЕРАПИЯ
Противогрибковая терапия должна быть назначена только после подтверждения диагноза. Оптимально, если противогрибковая терапия будет продолжена спустя 2 недели после получения отрицательной культуры и 4 недели после отсутствия грибов в цитологии. Для системной терапии можно использовать кетоконазол в дозах 2,5-10 мг/кг 1-2 раза в день, итраконазол 5-10 мг/кг 1-2 раза в день, тербинафин 10-30 мг/кг 1 раз в день [25]. Побочными явлениями этих препаратов могут быть анорексия, рвота, диарея, зарегистрированы случаи развития холангиогепатита.
Некоторые дерматологи не рекомендуют использование кетоконазола кошкам ввиду гепатотоксичности, отдавая предпочтение итраконазолу [1]. Однако имеются данные, что при длительном применении итраконазола, особенно в высоких дозах, у некоторых кошек может развиваться гепатотоксический эффект. По данным Moriello K. (2013), применение итраконазола в дозе 5мг/кг неделя – через неделю, является безопасным для большинства кошек, тем не менее авторы рекомендуют каждые 14 дней проводить контрольное определение активности трансаминаз и билирубина в сыворотке крови кошек, находящихся на лечении итраконазолом [24].
Флуконазол уступает по эффективности кетоконазолу и итраконазолу in-vitro, однако его назначение в дозах 2,5-5 мг/кг ежедневно курсом 21-28 дней оказалось эффективным при себорейном дерматите, вызванном Malassezia spp. Надо учитывать, что ввиду почечной экскреции флуконазола, необходимо избегать его применения при почечной недостаточности.
Имеются данные о высокой эффективности луфенурона (Lufenuron, Program® Novartis Animal Health) при дерматофитозе у кошек. Известно, что этот препарат, используемый ранее для борьбы с насекомыми (вызывает нарушения синтеза хитина у насекомых), также может воздействовать на синтез клеточной стенки у некоторых грибов.
ДИЕТА
Одним из критериев, характерным для реакций пищевой гиперчувствительности, является всесезонный характер кожных патологий, не устраняющийся после обработок против блох. Для подтверждения или исключения пищевой аллергии проводят провокационный тест после элиминационной диеты на протяжении 6-8 недель. Только в случаях, когда признаки зуда исчезают при использовании нового/ гидролизатного корма и возникают вновь при возвращении к предыдущему корму, можно сделать заключение о пищевой аллергии. Если же не наступает улучшение клинического состояния на новой диете, или же не возобновляется зуд при возвращении к прежнему корму, то можно свидетельствовать об отсутствии неблагоприятных пищевых реакций.
Таким животным применяют медикаментозные средства терапии, включающие глюкокортикоиды, циклоспорин, антагонисты к рецепторам гистамина, возможно, аллергенспецифическую иммунотерапию.
ГЛЮКОКОРТИКОИДЫ
Глюкокортикоиды часто используются в дерматологии, в противовоспалительных дозах они снижают активность и миграцию воспалительных клеток. Кортикостероиды очень эффективны в случаях атопии, они быстро устраняют симптомы, иногда даже в небольших дозах. Традиционно пероральные и инъекционные глюкокортикоиды применяются для лечения аллергических заболеваний кожи у кошек, однако некоторым кошкам требуется длительное их применение, что повышает риск развития побочных эффектов. Кошки, гиперчувствительные к укусам блох, также положительно отвечают на глюкокортикоиды. Однако таким животным могут требоваться большие дозы. При необходимости быстрого устранения зуда при терапии БАД кортикостероиды можно использовать только в комплексе со строгим контролем над блошиной инвазией [29]. Глюкокортикоиды могут быть вариантом выбора у животных с сезонным проявлением зуда в течение 1-2 месяцев в году в противовоспалительных дозах (преднизолон до 1 мг/кг, дексаметазон 0,1-0,25 мг/кг) через день. При атопии рекомендуется использовать глюкокортикоиды в минимально эффективной дозе, ориентируясь на наличие/отсутствие зуда. Таким образом, доза подбирается индивидуально, при этом в разные сезоны года она может варьировать.
Перед тем как задуматься об иммуносупрессивной терапии, необходимо быть иверенным в диагнозе. Необоснованное использование стероидов, основанное только на истории болезни и клинических признаках, может быть достаточно опасным, поскольку существует большое количество инфекционных болезней (грибковых, бактериальных, паразитарных), при лечении которых иммуносупрессивная терапия нежелательна. Пациенты, имеющие иммуноопосредованные болезни, нередко имеют вторичные инфекционные осложнения, которые необходимо устранять до проведения иммуносупрессивной терапии или параллельно с ней. Важно понимать, что реакция на эти препараты у каждой кошки с одинаковым диагнозом может быть различной, поэтому необходим индивидуальный подход к каждому пациенту. При терапии начинают со стартовых доз, постепенно снижая до наименьшей эффективной дозы. При отсутствии эффекта и развитии побочных признаков, имеет смысл отменить лечение или сменить препарат [25]. В исследовании Ganz Eva C. с соавторами (2012) было установлено, что применение кошкам в индукционной стадии метилпреднизолона в дозе 1,41 мг/кг и триамцинолона в дозе 0,18 мг/кг ежедневно показало высокую эффективность. Зуд был устранен в течение 7-14 дней, затем препараты применяли через день в поддерживающих дозах 0,54 мг/кг и 0,18 мг/кг соответственно. У кошек обеих групп было отмечено быстрое снижение числа эозинофилов в крови и повышение уровня фруктозамина, однако, не выходящее за пределы референсного интервала [15].
При локальных поражениях, возможно, является целесообразным местное использование глюкокортикоидов. В исследовании V.Schmidt с соавторами (2012),была дана оценка эффективности топикального применения спрея гидрокортизонаацепоната (Cortavance®,VirbacSA) у кошек с атопическим дерматитом. Спрей наносили один раз в день в дозе 2 нажатия на 10 см2 поверхности тела и оценивали зуд по шкале FeDESI. При этом не было выявлено никаких побочных эффектов, изменений в гематологии, биохимии, анализах мочи. У части кошек стало возможным применение спрея через день, а некоторым по-прежнему требовалось ежедневное использование [36].
Вероятность осложнений (в частности, сахарного диабета), возможных при длительном системном применении кортикостероидов, поддерживает интерес к разработке альтернативных методов лечения.
ЦИКЛОСПОРИН
Впервые данные об эффективности циклоспорина для лечения реакций гиперчувствительности у кошек были представлены в открытом исследовании, опубликованном Noli с соавторами [14,26].
Циклоспорин А является иммуномодулятором из группы ингибиторов кальциневрина.
На клеточном уровне циклоспорин а ингибирует активацию Т-лимфоцитов, эозинофилов, антиген-представляющих клеток, снижает секрецию провоспалительных цитокинов кератиноцитами и дегрануляцию тучных клеток, опосредованную IgE. После перорального введения пиковые концентрации и период полувыведения у кошек крайне нестабильны. Однако было доказано, что отсутствует корреляция между концентрациями циклоспорина в сыворотке крови и клиническим эффектом у кошек, поэтому в проведении этого анализа, в большинстве случаев, нет необходимости.
Пик концентрации наблюдается через час после перорального введения циклоспорина в дозе 5 мг/кг и колеблется от 100 до 1600 нг/мл при измерении методом жидкостной хроматографии под высоким давлением. Стоит отметить, что в зависимости от метода исследования, концентрации циклоспорина в крови кошек варьирует. Иммунолологическими методами получают, как правило, более высокие значения. Биодоступность циклоспорина у кошек довольно низка (29%) и кумуляция его, как правило, не наблюдается. Циклоспорин является липофильным, что обеспечивает более высокую его концентрацию в коже (в 4 раза выше, чем в сыворотке). Кормление до введения циклоспорина приводит к снижению биодоступности, однако, это не оказывает влияния на клинический эффект. Существует ряд исследований, посвященных лекарственным взаимодействиям циклоспорина. Известно, что циклоспорин взаимодействует с цитохромом P 450, поэтому при сопутствующем лечении кетоконазолом, итраконазолом, кларитромицином доза циклоспорина должна быть снижена. Также возможны взаимодействия с ранитидином, омепразолом, циметидином, эритромицином, дигоксином, фуросемидом, ципрофлоксацином, три-метапримом-сульфаниламидом и рядом других препаратов. Побочные эффекты циклоспорина включают желудочно-кишечные симптомы, анорексию, потерю веса и гингивит. Также зарегистрированы случаи развития отита и цистита на фоне применения циклоспорина у кошек, однако причинно-следственная связь до конца не изучена [19, 20].
Иммуносупрессия, вызванная циклоспорином, может привести к тяжелому течению токсоплазмоза, 2 вирусных инфекций [31,39] или неоплазии. Однако этот риск невелик (при использовании в рекомендуемых дозах для лечения атопии у кошек) [16].
Существуют рекомендации, что выходящие на улицу кошки должны быть проверены на IgG ктоксоплазмозу, поскольку заражение токсоплазмозом на фоне лечения циклоспорином может иметь негативные последствия. По крайней мере, серонегативным животным необходимо исключить выход на улицу и кормление сырым мясом на протяжении всего курса лечения. Напротив, серо-позитивным кошкам можно начинать лечение циклоспорином. Кошки с хроническими инфекционными заболеваниями, такими как FIV, FeLV, дерматофитоз также не должны получать циклоспорин. Кошки с хронической почечной недостаточностью и сахарным диабетом могут получать циклоспорин, но они должны находиться под регулярным наблюдением [9].
В исследовании Novartis, посвященном возможности вакцинации на фоне применения циклоспорина, кошки впервые были привиты, затем они получали циклоспорин А в дозе 24 мг/кг в течение 8 недель. После этого периода лечения они были повторно вакцинированы. В результате у кошек опытной группы были получены более низкие сывороточные титры, чем у контрольных животных, однако они оставались в референсных пределах для вакцинированных животных. Результаты этих исследований предполагают, что вакцинация может быть проведена во время лечения циклоспорином [9].
Результаты первого контролируемого исследования Wisselink с соавторами [41] показали, что клинические улучшения при лечении кошек с аллергией были замечены в обеих группах, как при использовании циклоспорина а в дозе 5 мг/ кг, так и в группе кошек, получавших преднизолон в дозе 0,5 мг/кг. В другом исследовании после этого были представлены доказательства, что более эффективной дозой для кошек с аллергией является 7 мг/кг [22]. Кроме того, было показано, что после начального этапа лечения от 6 до 8 недель, около 70% аллергических кошек можно переводить на использование циклоспорина А через день. После 4 дополнительных недель, 55% получали препарат только два раза в неделю, а 20% были все еще через день и 15% ежедневно. Только 10% кошек не ответили на лечение.
В целом, исследования показывают, что циклоспорин А является хорошим вариантом для лечения аллергических кошек и в, большинстве случаев, хорошо переносится.
АНТИГИСТАМИННЫЕ ПРЕПАРАТЫ
Антигистаминные препараты часто используются в терапии пациентов с зудом. Более того, положительный ответ у кошек наблюдается чаще, чем у собак. Однако пероральный прием кошкой антигистаминных препаратов на протяжении длительного времени, порой несколько раз в день, затруднителен для владельцев. Тем не менее, при наличии возможности и видимых клинических улучшений назначение антигистаминных препаратов предпочтительнее, чем глюкокортикоидов. Даже в случаях, когда отменить кортикостероиды не удаётся, нередко дополнительное использование антигистаминных препаратов позволяет значительно снизить дозу гормонов. Наиболее часто используются цетиризин (является ингибитором экзоцитоза эозинофилов) в дозе 5 мг/кошку каждые 12-24 часа, лоратидин в дозе 5 мг/кошку каждые 12-24 часа [25].
Различные антигистаминные препараты были использованы для лечения кошек с зудом и получены противоречивые результаты. Поэтому Wildermuth К. с соавторами (2013) было проведено рандомизированное двойное слепое плацебо-контролируемое клиническое исследование по применению этого класса препаратов у кошек. В этом исследовании кошки с атопическим дерматитом были разделены на опытную и контрольную группы, они получали перорально цетиризина гидрохлорид в дозе 1 мг/кг перорально один раз в день в течение 28 дней или плацебо соответственно. Кошек осматривали еженедельно и оценивали степень зуда. Исследования показали, что не выявлено статистически значимых различий между обеими группами, в связи с чем авторы этого исследования не рекомендуют цетиризина гидрохлорид для лечения кошек с атопическим дерматитом [40].
ЖИРНЫЕ КИСЛОТЫ
Незаменимые жирные кислоты необходимы для выполнения барьерных функций кожей, они являются компонентом клеточной мембраны. Пищевые добавки некоторых жирных кислот, таких как линолевая (из семян подсолнечника), гамма-линолевая (из масла вечерней примулы), эйкозапентаноевая (из жира морских рыб) могут оказывать противовоспалительный эффект, который связан со снижением продукции простаглан-динов и лейкотриенов. Также применение жирных кислот в комплексе с глюкокортикоидами может позволить снизить дозу последних. Идеальные дозы и соотношение омега 6/омега3 жирных кислот является объектом научных исследований и до конца не выяснено. Mueller Ralf S. (2000) рекомендует использовать 20 мг/кг в сутки эйкозапентаноевой кислоты и 20-50 мг/кг линолевой кислоты [25].
АЛЛЕРГЕН-СПЕЦИФИЧЕСКАЯ ИММУНОТЕРАПИЯ (АСИТ)
Доказательств эффективности и безопасности АСИТ у кошек значительно меньше, чем у собак. У кошек иммунотерапия разрабатывается на основе положительных результатов внутрикожных тестов. При этом, традиционно оценка результатов внутрикожных тестов у кошек считается более сложной, чем у собак. Чтобы облегчить оценку кожных проб у кошек, некоторыми авторами было рекомендовано внутривенное введение 10% раствора флуоресцеина [23]. В двойном слепом исследовании иммунотерапия с антигенами блохи оказалась неудачной в терапии кошек с БАД, более половины пациентов имели рецидив клинических признаков. Однако вероятность рецидива была обратно пропорциональна продолжительности иммунотерапии, что является перспективой для дальнейших научных исследований [23].
Литература
1. Ahman S, Perrins N, Bond R. Treatment of Malassezia pachydermatis-associated seborrhoeic dermatitis in Devon Rex cats with itraconazole – a pilot study. /Vet dermatol 2007;18:171-174.
2. Beatty J, Barrs V. Antemortem diagnosis and treatment of toxoplasmosis in two cats on cyclosporin therapy.Australian Veterinary Journal 2006; 84:30-5.A for feline atopy. /Vet Dermatol 2004; 15:p198.
3. Bourdeau P et al Characteristics of pruritus in flea related dermatoses in cats/SEVCO17 – 19 October, 2013. Barselona, Spain.
4. Bourdeau P, E Videmont, V Bruet, A Roussel, D Pin The use of spinosad in the management of pruritic dermatoses in cats: a study on 46 cases. SEVCO 17-19 October, 2013. Barselona, Spain.
5. Bryan J, Frank L. Food allergy in the cat: a diagnosis of elimination/Journal of Feline Medecine and Surgery. 2010;12:861-866.
6. Credille Kelly M, Thompson LoriA, Young Lisa M et al Evaluation of hair loss in cats occurring after treatment with a topical lea control/Vet Dermatol 2013; 24: p602.
7. Crosaz OA Legras,F Vilaplana-Grosso, J Debeaupuits, R' Chermette, B Hubert, J Guillo Generalized dermatitis associated with Malassezia overgrowth in cats: а report of six cases in France/ Medical Mycology Case Reports 24 January 2013.
8. Declercq J. A case of diet-related lymphocytic mural folliculitis in a cat. /Vet Dermatol. 2000;11:75-80.
9. Favrot C Cyclosporine therapy for feline hypersensitivity dermatitis. /26th Annual congress of the ESVD-ECVD 2013.Valensia Spaing. 144-145.
10. Favrot C Update on feline hypersensitivity dermatoses /26th Annual congress of the ESVD-ECVD 2013.Valensia Spain. Р142-143
11. Favrot C, Steffan J, Seewald W, et al. Establishment of diagnostic criteria for feline nonlea-induced hypersensitivity dermatitis. Veterinary Dermatology. 2012;23:45-50.
12. Ferreira D. et al. Identification of three different Demodex species in cats using a novel PCR assay/26th Annual congress of the ESVD-ECVD 2013. Valensia Spain Р192.
13. Foster AP, Roosje PJ. Update on feline immunoglobuline E (IgE) and diagnostic recommendations for atopy. In: AugustJR, ed. Consultation in Feline Internal Medicine (ed 4th). Philadelphia: Saunders W.B.; 2004:229-238.
14. Foster AP. Diagnosing and treating feline atopy. /Veterinary Medicine. 2002:226-240.
15. Ganz Eva C, Griffin Craig E, Keys DA, Flatgard Tami A Evaluation of methylprednisolone and triamcinolone for the induction and maintenance treatment of pruritus in allergic cats: a double-blinded, randomized, prospective study/ Veterinary Dermatology 2012 Volume 23, Issue 5, pages 387-e72.
16. Gregory CR, Madewell BR, Griffey SM et al. Feline leukemia virus-associated lymphosarcoma following renal transplantation in a cat. /Transplantation 1991; 52:1097-9.
17. Guillot J Malassezia yeasts & Malassezia dermatitis/ 1st International Veterinary Mycology Course 4-8 November 2013 / ISHAM-Veterinary Mycology Working Group (VMWG).
18. Guillot J The diagnosis of animal mycoses/ 1st International Veterinary Mycology Course 4-8 November 2013 /ISHAM-Veterinary Mycology Working Group (VMWG).
19. Heinrich NA, McKeever PJ, Eisenschenk MC. Adverse events in 50 cats with allergic dermatitis receiving ciclosporin./Veterinary Dermatology.2011;22:511-520.
20. Hobi S, Linek M, Marignac G, et al. Clinical characteristics and causes of pruritus in cats: a multicentre study on feline hy-persensitivity-associated dermatoses. /Veterinary Dermatology. 2011;22:406-413.
21. Kelly M. Credille, Lori A. Thompson, Lisa M. Young, Jeffery A. Meyer, Joseph R. Winkle. Evaluation of hair loss in cats occurring after treatment with a topical lea control product/Veterinary Dermatology Volume 24, Issue 6, December 2013,pages 602-e146.
22. King S, Favrot C, Messinger L et al. A randomised double-blinded placebo controlled study to evaluate an effective ciclosporin dose for the treatment of feline hypersensitivity dermatitis. Veterinary Dermatology. 2012.
23. Loewenstein Christine, Mueller Ralf S. A review of allergen-speciic immunotherapy in human and veterinary medicine /Veterinary Dermatology Volume 20, Issue 2, April 2009, P 84-98.
24. Moriello KA, Verbrugge M Changes in serum chemistry values in shelter cats treated with 21 consecutive days of oral itraconazole for dermatophytosis /Veterinary Dermatology Volume 24, Issue 5, October 2013, pages 557-558.
25. Mueller Ralf S. Dermatology for the Small Animal Practitioner. USA. 2000.
26. Noli C, Scarampella F. Prospective open pilot study on the use of ciclosporine for feline allergic skin disease./ Journal of Small Animal Practice. 2006;47:434-438.
27. ODair H, Markwell P, Maskell I. An open prospective investigation into etiology in a group of cats with suspected allergic skin disease. Veterinary Dermatology. 1996;7:193-202.
28. ODair H, Markwell P, Maskell I. An open prospective investigation into etiology in a group of cats with suspected allergic skin disease. / Veterinary Dermatology. 1996;7:193-202.
29. Prelaud P Guaguere E, Freiche V, Drouard C, Laforge H. The allergic cat. Prat Med Chir Anim Cie. 1999; 34:437-447.
30. Prost C. Les dermatoses allergiques du chat. Pratique Medicale et Chirurgicale de Animal de Compagnie.1993;28:151-164.
31. Robson DC, Burton GG. Cyclosporin: applications in small animal dermatology. /Veterinary Dermatology 2003; 14:1-9.
32. Roosje PJ, Thepen T, Rutten VPMG, Willemse T. Feline atopic dermatitis. /In: Thoday KL, Foil CS, Bond R, eds. Advances in Veterinary Dermatology, Volume 4. Oxford: Blackwell Sciences; 2002:178-187.
33. Rossi MA, Messinger L, Olivry T, Hoontrakoon R A pilot study of the validation of percutaneous testing in cats /Veterinary Dermatology Volume 24, Issue 5, pages 488-e115, October 2013.
34. Saridomichelakis MN, Koutinas AF. A retrospective study of 10 spontaneous cases of feline atopic dermatitis./European Journal of Companion Animal Practcice. 2001;11:177-183.
35. Scarampella F et al. Dermoscopic features of dermatophytosis in 11 cats with M. canis infection/26th Annual congress of the ESVD-ECVD 2013.Valensia Spain Р 217
36. Schmidt V et al Efficacy of a 0.0584% hydrocortisone aceponate spray in presumed feline allergic dermatitis: an open label pilot study/ Veterinary Dermatology Volume 23, Issue 1, February 2012,p 11.
37. Scott DW, Miller WH, Grifi n CE. Chapter 8. Skin immune system and allergic skin diseases. /In: Scott DW, Miller WH, Grifi n CE, eds. Muller and Kirk's Small Animal Dermatology (ed 6th). Philadelphia: W.B. Saunders Co.; 2001:543-666.
38. Silbermayr K J, Litschauer B, Sastre N, Ferrer L, Horvarth-Ungerbock C. Coproscopic detection and treatment of Demodex gatoi infestation in a Cornish rex cat in Austria/26th Annual congress of the ESVD-ECVD 2013. Valensia Spaing 219.
39. Vercelli A, Raviri G, Cornegliani L. The use of oral cyclosporin to treat feline dermatoses: a retrospective analysis of 23 cases. / Veterinary Dermatology 2006; 17: 201-6.
40. Wildermuth Kerstin, Zabel Sonja, Rosychuk Rod A. W. The efficacy of cetirizine hydrochloride on the pruritus of cats with atopic dermatitis: a randomized, double-blind, placebo-controlled, crossover study /Veterinary Dermatology Volume 24, Issue 6, December 2013, pages 576-e138.
41. Wisselink MA, Willemse T. The eficacy of cyclosporine A in cats with presumed atopic dermatitis: A double blind, randomised pred-nisolone-controlled study. The Veterinary Journal. 2009;180:55-59.
42. Young KM, Moriello KA. Eosinophils and eosniophilic diseases /In: August JR, ed. Consultation in Feline Internal Medicine. Philadelphia: Saunders, W.B.; 2004.

Назад в раздел

















