Жидкостная цитология. Качественный преаналитический этап цитологического исследования в ветеринарии
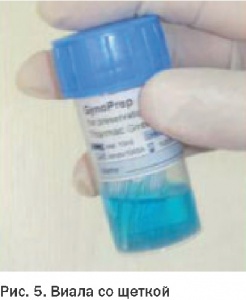
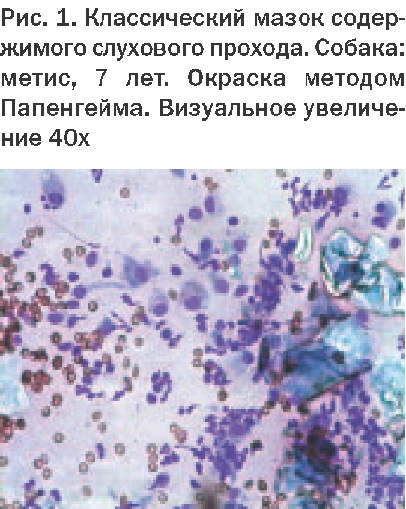
Еще фото
Автор (ы): Н.В. Литвинов, к.в.н., ветеринарный врач-цитолог, член ESVCP, эксперт органа по сертификации качества Метрологической академии РФ, научный руководитель Ветеринарного центра клинической цитологии и компьютерной цитометрии CYTOVET, г. Санкт-Петербург
Журнал: №3-4 - 2011
Ключевые слова: жидкостная цитология (ЖЦ), цитологическое исследование, преаналитический этап, цитоцентрифугирование, клеточное обогащение, фильтрация (ThinPrep), стайнер
Цитологический метод исследования – один из важных инструментов, с помощью которого осуществляется диагностика многих патологических процессов. Данный метод имеет бесспорные преимущества перед более инвазивными методиками прижизненной морфологии.
«Диагностическая пункция является безопасным для больного методом, т.е., не вызывает ускорения роста злокачественной опухоли и ее метастазирования, технически проста, может быть применена неоднократно, занимать мало времени для обработки полученного материала». (Петрова А.С. Цитологическая диагностика опухолей и предопухолевых процессов. АМН СССР.М:,1985, с. 7.)
Технически для приготовления информативного препарата требуется минимальное количество материала. Аспирационные и пункционные методы биопсии малотравматичны и практически безболезненны, доступна любая локализация в организме животного.
Цитологическая диагностика стала неотъемлемой частью клинического обследования животных в практике ветеринарного врача. Но следует отметить, что успех цитологической диагностики, помимо квалификации цитолога, во многом зависит оттого, каким образом был получен материал, как он был обработан, и насколько точно было составлено сопроводительное направление с описанием места локализации исследуемого патологического участка и другие моменты преаналитического этапа до поступления в цитологическую лабораторию.
Преаналитический этап является одним из основных этапов, где происходит (зачастую неконтролируемое) снижение контроля качества в лабораторной и цитологической диагностике.
Основная форма контроля преаналитического этапа – периодические внешние и внутренние проверки, внедрение инструкций, наставлений и проведение тренингов на рабочих местах, снижающие ошибки персонала.
Для создания условий по стандартизации преаналитического этапа и обеспечения качества цитологического исследования внедрены современные методы получения материала, пробоподготовка и доставка.
Жидкостноя цитология (ЖЦ) – liquid based cytology (LBC) – новый стандарт для приготовления монослойных цитологических препаратов.
Большинство ошибок, совершаемых при взятии или переносе патологического материала для приготовления мазков, является основной причиной ложных результатов диагностики больного животного, снижающей статус и качество работы цитологической лаборатории, дискредитации врача морфолога. Нередко врачами осуществляется некомпетентное пунктирование и аспирирование из новообразования с последующим неравномерным распределением материала на стекле. Слишком толстый мазок является причиной получения неполноценного материала. Слизь и кровь, присутствующие во взятом материале, мешают перенести на мазок клетки, также материал невозможно равномерно перемешать. При переносе материала на стекло традиционным способом клетки могут не попасть в препарат. Подсушивание и потеря прилипших к инструменту клеток значительно уменьшает диагностическую информативность микропрепаратов.
Обилие преаналитических ошибок у такого рода специалистов, становится основным барьером в собственной диагностической работе и невозможностью оценить преимущества цитологического исследования.
Описанные методы ЖЦ позволяют исключить эти негативные факторы в существующих недостатках преаналитического этапа.
Основные этапы
А. Долабораторный преаналитический этап
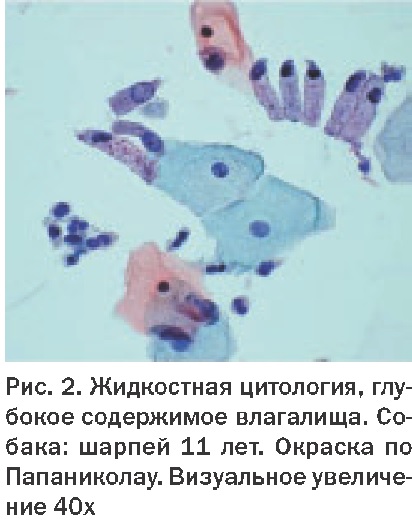
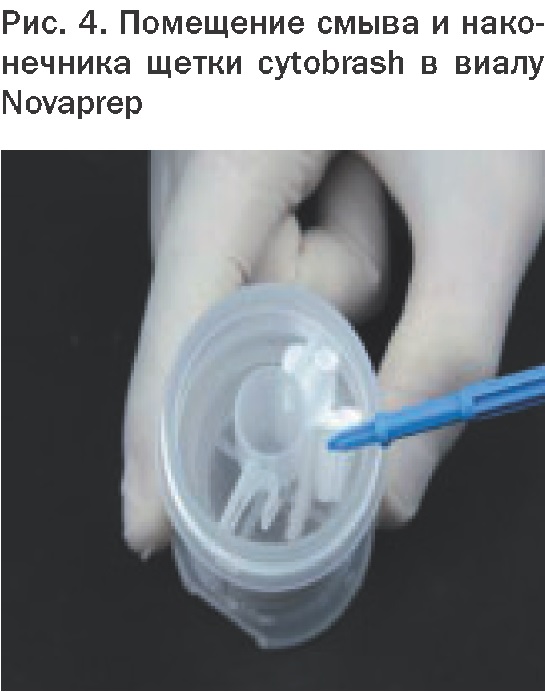
Получение материала классическими способами (аспирация, пункция, эксфолиат, отпечаток и др.) с применением современного инструментария (цитощетки cervix-brush, cytobrash, урогенитальные щетки, современные цитологические троакары и биопсийные иглы стандарта sterile eo и др.).
1.Транспортная среда – консервант (PreservCyt, Novaprep – solution preservative). Собранный клеточный материал, помещенный в виалу с консервантом (PBS, коммерческие спирто-эфирно-формалиновые смеси и др.), препятствует повреждению клеток, позволяет отфильтровать слизь и избежать бактериального загрязнения, давая возможность в оптимальных условиях доставить пробу в лабораторию. Позволяет сделать несколько цитологических препаратов из одной пробы.
Важно отметить, что материал можно хранить от недели до нескольких месяцев, т.к. в консерванте он устойчив к колебаниям температуры (не замораживать!). В некоторых консервирующих средах клеточный материал пригоден для дополнительных лабораторных исследований (генетически-молекулярных, ИЦХ, ЦХ и др.).
Б. Лабораторный преаналитический этап
Способы получения монослойных цитологических препаратов при переносе клеток из фиксирующего раствора на стекло с использованием методов центрифугирования, осаждения и/или фильтрации.
1. Варианты реализации методики жидкостной цитологии с помощью цитоцентрифуг (Cyto-Tek, CytoSpin, DiffSpin и др.). Цитоцентрифугирование, на сегодняшний день, уже относится к ручному способу приготовления мазков.
Здесь следует отметить преимущества этой методики – простоту в освоении и внедрении, возможность изготовления нескольких стекол из одного образца, удобное обслуживание и малозатратность при небольшом потоке исследований.
Выделены и недостатки данной методики: требуются наработки и навыки от лабораторного сотрудника в приготовлении мазка в зависимости от вида клеточного материала. Это полностью ручной способ с низкой производительностью. В большинстве случаев необходимо разведение образца при высокой клеточности материала (центрифугирование в обычной центрифуге, разведение осадка в 1000 мкл фиксатора), а это требует использования дополнительного оборудования (вортекс, нефелометр), отсутствуют стадии очищения образца, центрифугирование может приводить к разрушению клеточных комплексов, мультинаслаиванию.
2. Клеточное обогащение на градиенте плотности (SurePath) - «золотой стандарт» качества:
• Первоначально требует стандартизованного перемешивания виал с материалом (вортекс);
• Приготовление супернатанта (дополнительный аппарат по наслоению + двойное центрифугирование);
• Приготовление монослойного мазка происходит из супернатанта и в некоторых комплектах оборудования производится стандартизированная окраска препарата (опционально);
• Все стадии процесса можно наблюдать и прервать/вмешаться в любой момент;
• Наличие аппарата автоматизированного предпросмотра (аппарат не позволяетсканировать, сохранять изображения, осуществлять обмен и телеконференции).
В процессе приготовления супернатанта происходит удаление части диагностического материала(кровь, воспалительные элементы, это удобно при исследовании мазков на гормональную насыщенность, но категорически недопустимо при исследовании воспалительных процессов и онкоморфологии!). Несколько этапов центрифугирования может приводить к разрушению клеточных комплексов, деформации клеточных структур. Низкая степень автоматизации, соответственно, большой объем ручного труда – до 50% времени.
Существенный объем специальных расходных материалов (большое количество скрытых трат) – сложная система финансового планирования закупок.
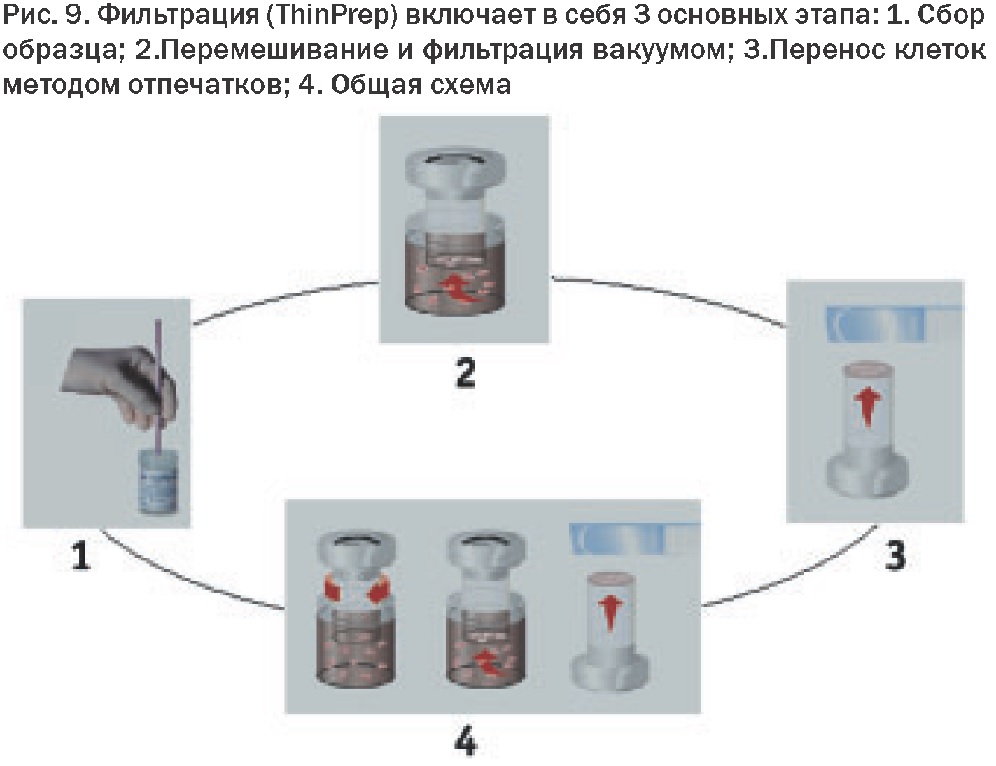
3. Фильтрация (ThinPrep):
• Автоматическое перемешивание, фильтрация вакуумом и перенос клеток методом отпечатков с соблюдением стандартов и контроля качества;
• Высокая степень автоматизации (до 70%);
• Имеется система автоматизированного предпросмотра. Минимальное количество расходных материалов;
• Простая система расчета стоимости исследования.
Одним из основных недостатков данной системы является закрытая система штрих-кодирования (в большинстве случаев ее невозможно совместить с внутриклинической (внутрилабораторной) системой ЛИС и/или других компьютерных программ статучета, невозможна работа без штрих-кодов). Большой риск повреждения клеток, особенно разрушения комплексов (применение вакуумной аспирации). Отсутствует возможность приготовления нескольких стекол из одной пробы. Относительная дороговизна системы.
4. Автоматизированная жидкостная цитология – комбинированная технология.
Используется цитологический процессор NOVAPREP®NPS.
Автоматический метод пассивной фильтрации и двойного осаждения (высокий стандарт качества).
• Специально разработанные виалы, устройство для съема наконечников цитощеток, фильтр для отделения слизи, конус для накопления осажденных клеток.
• Возможность одновременного/ отсроченного приготовления нескольких стекол из одной виалы, 10 режимов для приготовления цитологических препаратов (от скрининга PAP-test до высококонцентрированного для разреженных проб).
• Система приготовления проб для молекулярных исследований (автоматизированный отбор в микропробирки типа Eppendorf).
• Система предотвращения контаминацией вирусами.
• Система приготовления проб для любых дополнительных исследований (автоматизированный отбор в рутинные лабораторные пробирки). Полностью автоматизированный процесс пробоподготовки.
• Снижение доли ручного труда на 90-95%. Ручной труд занимает от 2 до 5 минут на загрузку виал в штатив процессора (5 минут на штатив, около 30 сек на пробу) и выбор режима в компьютерной программе.
• Отсутствие потерь биоматериала (100% в исследовании).
Кардинальное изменение качества тестов и достоверности результатов. Один аппарат пробоподготовки для всех видов исследований (микроскопия, иммуноцитохимия, молекулярные методы). Универсальная система идентификации (открыта для любых систем кодирования – ручное, штрих-кодирование и т.п.).
Недостатки метода: значительная дороговизна системы, технического сопровождения и расходных материалов.
Области применения различных методов жидкостной цитологии
Для целей первичного внедрения в условиях крайне ограниченных ресурсов более всего подходит метод цитоцентрифугирования.
Для целей рутинной скрининговой и клинической, а также научной практики более всего подходит комбинированная технология Novaprep®.
Для целей научного поиска в цитологической практике служит система клеточного обогащения (SurePath), зарекомендовавшая себя как золотой стандарт качества (при условии наличия персонала для обеспечения функционирования).
Методы окраски цитологических мазков
1. Ручной способ окраски стекол:
а) рельсовый; б) в кюветах.
Классические методы окраски препаратов с применением ручного труда с низким уровнем контроля и стандартов преаналитического этапа.
2. Автоматический способ окраски - «золотой стандарт» качества окрашивания препаратов с соблюдением режимов окраски, отвечающий требованиям внутрилабораторного преаналитического этапа.
Характеристики приборов соответствуют различным требованиям диагностических и научных лабораторий, в зависимости от пропускной способности и исследовательского подхода.
Заключение
Общепринятое мнение о лабораторном исследовании, как о качественном исследовании, теряет свой смысл при равнодушном и некомпетентном соблюдении преаналитического этапа. Однако аналитический этап является очень узкой стадией лабораторной работы и не может считаться полноценным при неправильно составленном направлении на исследования, при нарушении правил аспирирования и биопсии, ошибках, допущенныхпри транспортировке биоматериала в лабораторию. В то же время запоздавший отчет о лабораторных исследованиях или неправильно интерпретированные данные лабораторного исследования, могут стать существенной преградой в адекватной диагностике и лечении больного животного.
Представленные методы жидкостной цитологии и автоматизированные системы окраски позволяют добиться высокого уровня преаналитического этапа, способствуют качественному цитологическому исследованию и достижению международных стандартов лабораторной диагностики (ISO 9001, ISO 15189 -2009).











Назад в раздел


















