Офтальмологические проявления вируса инфекционного перитонита кошек/ Ophthalmic manifestations of feline infectious peritonitis
Еще фото
Автор (ы):
Л.А. Соломахина, главный врач, врач-офтальмолог,
О.О. Смирнова, к.б.н., ветеринарный врач-терапевт
Организация(и):
Воронежский ветеринарный комплекс «Кот М@троскин», Воронеж
Ветеринарная клиника неврологии, травматологии и интенсивной терапии, г. Санкт-Петербург
Журнал: №1 -2017
Аннотация
Вирус кошачьего инфекционного перитонита (FIP/ FIPV) является биотопом (или штаммом) семейства кошачьих коронавирусов (FCoV), который наряду с кошачьим кишечным коронавирусом (feline enteric corona viruses (FECV)) имеет широкое распространение во всем мире.
Feline infectious peritonitis(FIP) viruses (FIPVs) are biotypes (or strains) of feline corona virus (FCoV), along with the feline enteric corona viruses (FECV), and have a worldwide distribution.
Кошачья коронавирусная инфекция может протекать бессимптомно, приводить к кишечному заболеванию или инфекционному перитониту кошек (FIP), который вызывает диссеминированный пиогранулематозный васкулит (Addie & Jarrett, 1992; Addie et al., 1995; Kipar et al., 2005). Вирус FIP размножается в макрофагах, что приводит к осаждению вируснагруженных макрофагов в пределах эндотелия мелких кровеносных сосудов (Kipar et al., 2005).
Эпидемиология
FIP – заболевание, возникающее преимущественно у молодых животных в возрасте между отъемом и 3 годами. По статистике около 50% кошек с FIP моложе 2 лет (наиболее часто заболевание возникает у кошек до полутора лет).
FECV эндемичен для условий большого скопления кошек. 75–100% случаев возникает в условиях большой скученности животных (приюты, зоомагазины, питомники, у владельцев, которые держат большое количество кошек) в отличие от 25% домашних кошек при одиночном содержании. Мутации обычно приводят к возникновению единичного спорадического случая заболевания. Эпизоотии редки и остаются нераспознанными, так как большинство кошек с FIP не выделяют вирус. Вспышка заболевания обычно возникает неожиданно, когда у нескольких кошек проявляется заболевание в период нескольких месяцев, а затем больше ни одна кошка не болеет в течение нескольких лет.
Заболевание вызывается кишечным коронавирусом (FECV), который мутирует и приобретает способность поражать макрофаги (FIPV). FECV заражает и размножается только в энтероцитах и приводит к диарее, FIPV имеет дополнительный тропизм к макрофагам и может реплицироваться внутри этих клеток, в конце концов приводя к FIP. Макрофаги несут FIPV к тканям и внутренним органам. Точный механизм, ответственный за более высокую вирулентность FIPV по сравнению с FECV, в настоящее время неизвестен. Однако у кошек с иммуносупрессией в процессе тяжелой FECV-инфекции и репликационной нагрузки мутация FECV происходит с большей вероятностью, что приводит к повышенной вирулентности и трансформации в FIPV.
Недавнее исследование оценки распространенности FIP у отдельных пород сообщает повышенный риск развития болезнь у абиссинских, бенгальских, бирманских, гималайских кошек, а также рэгдоллов и рексов.
Сексуально интактные кошки и чистокровные кошки более склонны к развитию FIP (Pesteanu-Somogyi et al., 2006).
Пути передачи
FECV передается фекально-оральным путем. После попадания в организм вирус размножается в эпителиальных клетках тонкого отдела кишечника (энтероцитах), вызывая развитие субклинических признаков заболевания кишечника и выделяется через фекалии. Он также может реплицироваться в небных миндалинах, в этом случае он выделяется со слюной. Противодействует инфекции гуморальный иммунитет (Ig A). FIP возникает, когда FECV мутирует и приобретает способность размножаться в макрофагах, превращаясь в системный внутриклеточный патоген. Наиболее важный фактор при борьбе с FIP – это клеточный иммунитет.
Патогенез
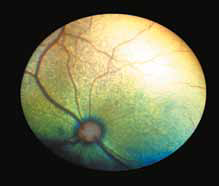
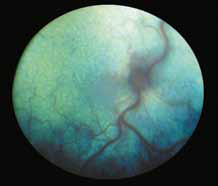
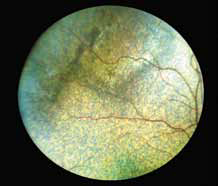
Стресс может предрасполагать кошек к болезни. FIP является иммунным комплексом заболевания, возникающим в результате взаимодействия между вирусом или его антигеном и специфическими противовирусными антителами. Реакция приводит к пиогранулематозному васкулиту, который влияет на органы, поставляемые этими кровеносными сосудами, в том числе сетчатку «perivascular cuffing» (рис. 1, 2).
Кошки с клиническим FIP могут демонстрировать эффузивную («влажную»/выпотную) (рис. 3, 4) или неэффузивную («сухую») форму болезни. Эффузивная болезнь, как правило, протекает в более острой форме. Неэффузивная форма развивается в течение более длительного периода и происходит в результате частичного иммунитета к вирусу.
Клеточный иммунитет наиболее важен при борьбе с FIP. Гуморальный иммунитет может также развиваться, но антитела обладают небольшой ценностью и могут даже оказывать негативное влияние.
Гуморальный иммунитет с активным клеточным иммунитетом способствует выздоровлению. В этом случае инфекция ограничивается локализацией в мезентериальных лимфатических узлах. Активность вируса подавляется, и животное выздоравливает (может даже не заболеть). Но в случае если у переболевших животных не происходит полной элиминации вируса, позднее развивается иммуносупрессия, и заболевание рецидивирует. Этот факт объясняет ситуации, когда у пожилых кошек, которые живут дома небольшой популяцией, развивается FIP.
Гуморальный иммунитет без клеточного иммунитета приводит к развитию выпотного, или влажного FIP, который является наиболее острой и частой формой FIP. У животных возникает выпот при воспалении вокруг кровеносных сосудов в результате того, что макрофаги высвобождают лимфокины, а также в результате местной анафилактической реакции, которая приводит к васкулиту. Опсонизация антител к вирусу позволяет лучше проникать в макрофаги.
Гуморальный иммунитет с частичным клеточным иммунитетом ведет к развитию сухого FIP (классическая гранулематозная форма заболевания). В данном случае вирус отграничивается не полностью. В небольших количествах он распространяется по организму, что приводит к большему выходу воспалительных клеток в очаг и развитие гранулемы.
Клиническое проявление
Общие признаки:
- перемежающаяся лихорадка, не отвечающая на введение антибиотиков. FIP обладает иммуносупрессивными свойствами, и температура, если она обусловлена вторичной инфекцией, может понижаться;
- хроническая и прогрессирующая анорексия, депрессия и потеря веса;
- медленный рост котят.
Влажная форма:
1) перитонит: увеличение живота в объеме из-за скопления свободной жидкости, которая представляет собой вязкий желтоватый экссудат, с большим количеством фибринозных нитей; тестоватость и иногда болезненность живота. Воспаление сосудов сальника;
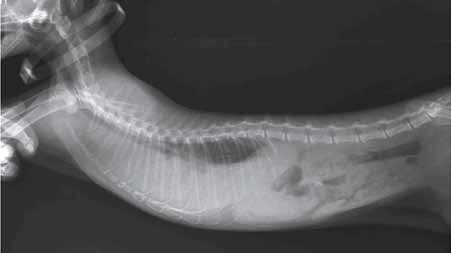
2) экссудативный плеврит: скопление в плевральной полости экссудата, что способствует появлению дыхательной недостаточности (рис. 5 а, b).
Сухая форма:
1) гранулемы преимущественно в перитонеальной полости;
2) увеличение лимфатических узлов, особенно мезентериальных;
3) часто встречаются признаки поражения ЦНС, так как в этом случае иммунная система хорошо контролирует заболевание в организме, но не может проникнуть в ЦНС, чтобы воздействовать на вирус. Так как при влажном FIP клеточный иммунитет снижен, происходит нарушение функции других органов до того, как вирус сможет вызвать значительное поражение ЦНС. Чаще всего затрагивается спинной мозг, но могут поражаться другие отделы ЦНС, вызывая параличи, судороги и полинейропатии. Именно поэтому при поступлении на прием молодой кошки с неврологическими симптомами необходимо исключить FIP.
Офтальмологические проявления FIP
Глазные поражения очень распространены при сухой форме FIP (Andrew, 2000; Foley et al., 1998; Pedersen, 1997). Болезнь часто была установлена как посмертная находка у кошек с увеитом.
Общие глазные симптомы включают болезненность глаз (может проявляться как анорексия или депрессия) и слезотечение. Причина боли в данном случае – спазм цилиарного тела, и поэтому для устранения этого симптома необходимы циклоплегики (атропин 1% глазные капли).
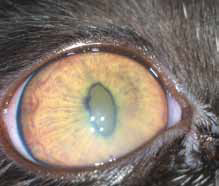
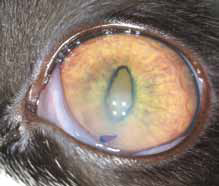
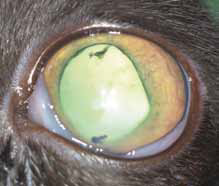
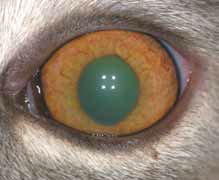
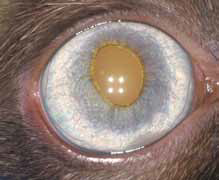
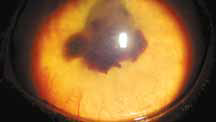
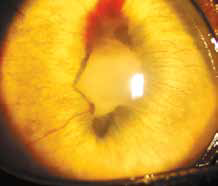
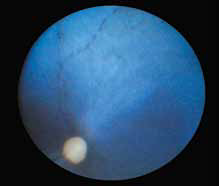
Специфические глазные симптомы включают ирит с изменением цвета радужной оболочки глаза, двусторонний передний гранулематозный увеит, часто с большими роговичными преципитатами типа «бараньего жира», (mutton-fat keratic precipitates) и фибринозный экссудат в передней камере глаза с вспышками ВГЖ, кровоизлияния в переднюю камеру, хориоретинит с пиогранулематозным экссудатом вокруг сосудов сетчатки, ретинальные геморрагии и отслойку сетчатки, неврит зрительного нерва (Campbell & Reed, 1975; Doherty, 1971; Montali & Strandberg, 1972; Slauson & Finn, 1972) (рис. 6–12, 15, 16). Зачастую у кошек наблюдается вторичная к увеиту катаракта, увеальная глаукома и вторичная люксация хрусталика.
Неврологические признаки могут также присутствовать из-за фокусного, мультифокального или диффузного поражения ЦНС. Глазные поражения были отмечены примерно в 50% случаев у кошек с неврологическими проявлениями, или примерно в 15% от общего числа случаев FIP, в одном исследовании. Гистопатологическое исследование глаз кошек с увеитом выявило 20% глаз с типичными для FIP поражениями, но в клиническом исследовании 53 случаев кошачьего увеита только один был диагностирован как FIP.
Передний увеит из-за FIP происходит либо в одиночку, либо совместно с задним увеитом (хориоретинитом) и невритом зрительного нерва и является аналогичным с клиническими проявлениями синдрома FeLV. Кроме того, передний увеит и/или хориоретинит может развиваться с или без параллельных системных признаков (Campbell & Reed, 1975; Carlton et al., 1973; Disque et al., 1968; Doherty, 1971; Hardy & Hurvitz, 1971; Kline et al., 1994; Poland et al., 1996; Sherding, 1979; Slauson & Finn, 1972; Sparkes et al., 1994; Wolfe & Griesemer, 1966).
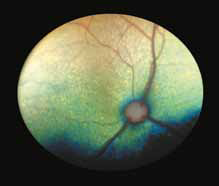
При FIP, а также при опухолевых заболеваниях воспалительные клетки часто накапливаются вокруг сосудов сетчатки, как они это делают в любых других тканях. Тем не менее, в глазах, в отличие от любого другого органа, эту реакцию можно визуализировать в естественных условиях с использованием офтальмоскопа (рис. 1, 2). Васкулит или периваскулярные пиогранулемы/«perivascular сuffing» ( скопление лейкоцитов вокруг кровеносных сосудов) видны в виде белого или серого цвета оболочки вокруг сосудов, которая иногда затемняет их цвет .
Периваскулярные пиогранулематозные поражения при FIP ассоциированы с более тяжелой болезнью у серопозитивных кошек и совместимы с иммуноопосредованной Arthus-type реакцией (феномен Артюса), а не прямой вирусной токсичностью. Феномен Артюса (N. M. Arthus, 1862–1945, франц. иммунолог) – местная гиперергическая воспалительная реакция с некрозом тканей, вызываемая преципитацией комплекса аллерген + антитело в сосудистой стенке и тканях.
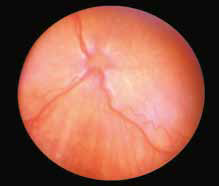
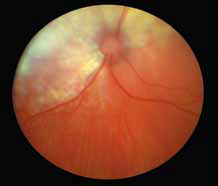
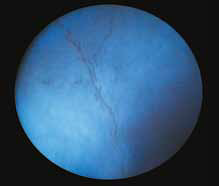
Повышение общего белка в плазме крови (синдром повышенной вязкости/гипервискозный синдром) (рис. 7, 13, 14) при FIP приводит к утолщению и извилистости сосудов сетчатки, а также их перекручиванию. При данном синдроме также может наблюдаться папиллярный отек ДЗН, кровоизлияния сетчатки, интраретинальные кисты, буллезная отслойка сетчатки, дистрофия сетчатки, что может привести к слепоте. Клинические признаки появляются, когда вязкость сыворотки повышается в 4–5 раз от нормы. В терминальной стадии заболевания можно увидеть появление «перетяжек» в сосудах сетчатки (рис. 17).
Диагностика
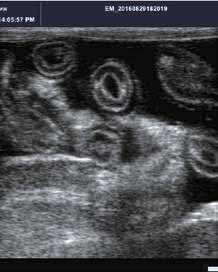
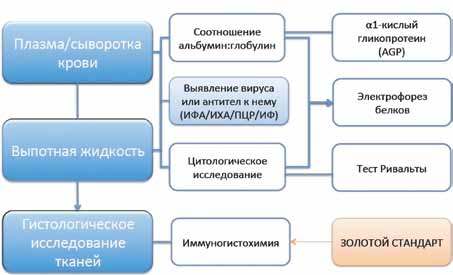
Ни один диагностический тест не может подтвердить наличие FIP. До сих пор отсутствует метод диагностики со 100% специфичностью и 100% чувствительностью. Нередко диагноз «вирусный перитонит» – это сочетание многих данных, которые приводят клинициста к заключению о болезни. К таким данным относятся: анамнез, клинические признаки, гематологические и сывороточные биохимические аномалии, ультрасонографические изменения, серологические результаты, цитологические и биохимические находки в образцах выпота, гистопатология и иммуногистохимия патологического материала, результаты исследования ПЦР патологического материала. Каждая находка дает «вероятность для FIP» .Чем выше балл, тем больше вероятность заболевания. Золотым стандартом диагностики FIP является посмертное гистологическое исследование (окрашенные гематоксилином-эозином ткани содержат пиогранулематозные узелки из макрофагов, нейтрофилов, лимфоцитов, плазматических клеток) и иммуногистохимия. Немногие организмы вызывают схожую картину.
Анализ крови:
- незначительное увеличение количества лейкоцитов и нейтрофилов и небольшое снижение лимфоцитов;
- анемия при хроническом заболевании;
- повышение уровня иммуноглобулинов и общего белка/гиперпротеинемия (поликлональная гаммапатия у 50% кошек с выпотной формой FIP и 70% кошек с сухой формой FIP);
- билирубинемия и билирубинурия вследствие эритрофагоцитоза (редко, в конечной стадии).
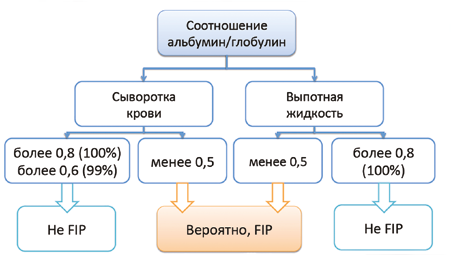
Выпотная жидкость при FIP воспалительного происхождения: желтый, обильный, тягучий, содержащий большое количество белка пиогранулематозный экссудат. Может содержать кровь. Цитоз 500–30 000 клеток/мкл. Белок обычно выше 45 г/л и состоит в большей степени из γ-глобулинов и α2-альбуминов. Для FIP характерно низкое альбумин/глобулиновое соотношение в выпоте и крови. Взаимосвязь альбумино-глобулинового отношения и диагностики FIP отображена на рис. 18. Высокое альбумин/глобулиновое соотношение в выпоте и крови позволяет достаточно уверенно исключить FIP в качестве причины возникновения выпота.
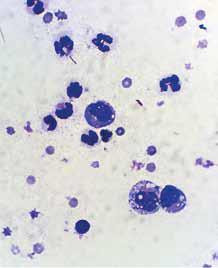
Цитология
Цитологическое исследование жидкости позволяет исключить опухолевые причины
выпота.
Цитограмма: лимфоциты, плазматические
клетки, макрофаги, дегенерированные нейтрофилы.
Осажденный белок преципитирует в виде розового зернистого вещества (фон
препарата).
Проба Ривальты
Про́ба Рива́льты – биохимический тест для дифференцирования транссудата и экссудата у человека (в настоящее время не используется с данной целью в связи с разработкой более чувствительных тестов). Проба названа именем итальянского исследователя Фабио Ривальта (итал. Fabio Rivalta), являющегося автором теста. Это простой и дешевый тест заключается во внесении выпотной жидкости в раствор уксусной кислоты, в результате чего образуется преципитат.
Пробу Ривальты можно произвести, приготовив реагенты самостоятельно или воспользовавшись готовыми наборами Rivalta FIP Vet tube (Megacor, Austria).
Проведение пробы Ривальты (рис. 19).
1. В пробирку внести 7–8 мл дистиллированной воды.
2. Добавить 1 каплю (20–30 мкл) ледяной уксусной кислоты, смешать.
3. Внести в раствор 1 каплю (20–30 мкл) выпотной жидкости на поверхность раствора уксусной кислоты.
Интерпретация пробы Ривальты.
Отрицательный результат: капля растворяется в жидкости, раствор остается прозрачным.
Положительный результат: падающая капля экссудата образует помутнение в виде белого облачка, которое либо остается сверху, либо опускается на дно пробирки.
Согласно исследованию, проведенному на 497 кошках с исключенным или подтвержденным FIP, тест Ривальта имел чувствительность 91,3% и специфичность 65,5% для диагностики FIP.
Отрицательная прогностическая значимость теста составляет 93,4% – из 1000 кошек с отрицательным тестом Ривальта только у 66 другими методами подтвержден FIP, тогда как у 934 кошек не было диагностировано заболевания.
Положительная предсказательная ценность теста составила 58,4% – из 1000 кошек с положительным тестом Ривальта 584 были больны FIP, тогда как у 414 были выявлены другие заболевания(бактериальные инфекции, лимфома и т.д.).
Отсюда можно сделать вывод, что при подозрении на FIP у кошек с выпотными жидкостями удобно проводить теста Ривальта, при этом отрицательные результаты теста говорят о низкой вероятности диагностирования заболевания.
Синовиальная жидкость: может быть воспалительного характера с повышенным количеством нейтрофилов.
ЦСЖ: может содержать повышенное количество нейтрофилов и общего белка.
Цитология ВГЖ: фибрин, красные кровяные клетки, моноциты и нейтрофилы.
Интерпретация серологических методов диагностики при FIP сопряжена с трудностями. Серология всего лишь выявляет антитела, которые указывают на то, что кошка заражена или была заражена коронавирусом (Andrew, 2000). Кроме того, тесты выявляют антитела к любому коронавирусу, и дифференцировать FECV от FIP невозможно. Высокий титр антител к коронавирусу и гипергаммаглобулинемия при наличии характерных клинических признаков указывает на FIP. Средние, низкие или даже отрицательные титры не исключают инфекцию. Титр антител может снижаться до 1:25 на терминальной стадии заболевания. Титры обладают меньшей диагностической ценностью у кошек из питомников, так как в питомниках животные обычно положительны по FECV. Учитывая неправильную интерпретацию серологических тестов, до сих пор эвтаназируется большое количество кошек, которые не больны FIP, а имеют всего лишь антитела к FECV. Антитела к коронавирусу выявляют у 80–90% кошек в кошачьих питомниках и у 10–50% особей домашнего содержания, но по статистике только 5–10% особей, инфицированных FCoV, заболевают FIP. Для диагностики заболевания нельзя использовать только результаты серологических исследований на FIP.
ПЦР
Методика ПЦР достаточно чувствительна для выявления как FIPV в патологическом материале при заболевании, так и FECV в кале при носительстве.
При влажной форме методом ПЦР должен быть исследован выпот, аспирированный из брюшной или грудной полости.
При сухой форме можно исследовать следующий материал:
- ткань пораженного лимфоузла, взятую методом тонкоигольной или интраоперационной биопсии;
- ткань гранулемы, полученную интраоперационно;
- цереброспинальную жидкость при наличии симптомов поражения ЦНС;
- жидкость передней камеры глаза при наличии увеита.
Материал должен быть получен качественно. Например, экссудат из брюшной или грудной полости следует набирать так, чтобы при аспирации не успел сформироваться сгусток. Крайне желательно постараться не контаминировать материал походной кровью. Такие погрешности отбора проб могут осложнить диагностику методом ПЦР и исказить полученный результат. На сегодняшний день лаборатории не предоставляют возможности дифференциации FIPV от FECV. Но для клинициста это не имеет принципиального значения, поскольку очевидно, что при обнаружении генетического материала патогена, например, в плевральном экссудате, это может быть только результатом мутации FECV в FIPV.
Крайне важно понимать, что обнаружение FECV в кале не является поводом для установления диагноза «вирусный перитонит». Это совершенно не равноценные понятия. Эта находка будет свидетельствовать лишь о том, что на данный момент кошка выделяет коронавирус с калом.
Патологоанатомическое заключение
Влажный FIP: при гистопатологии наблюдается диффузное воспаление серозных оболочек, отграниченное небольшим пиогранулематозным поражением.
Сухой FIP: гранулематозные поражения возникают преимущественно в брюшной полости, наиболее часто поражают почки, мезентериальные лимфатические узлы и печень. При гистопатологии выявляют макрофаги, окруженные плазмоцитарными клетками и лимфоцитами, указывающими на активный процесс.
Методы диагностики FIP схематично изображены на рис. 20.
Лечение
Лечение, которое является по существу симптоматическим и поддерживающим, включает в себя:
1) антибиотики широкого спектра действия;
2) преднизолон в виде монотерапии или в сочетании с циклофосфамидом или хлорамбуцилом. Курс лечения 2–3 недели. При отсутствии эффекта лечение прекращают. Если на данное лечение присутствует положительный ответ, его продолжают еще минимально 3 месяца. Каждую неделю проводится ОАК, чтобы проверить, нет ли супрессии костного мозга при использовании комбинированной терапии.
Преднизолон применяется внутрь в дозе 50–100 мг/м2 /день или 4 мг/кг/день внутрь 10–14 дней, затем 2 мг/кг/день в течение 10–14 дней, затем 1 мг/кг/день в течение 10–14 дней, затем 0,5 мг/кг/день в течение 10–14 дней, затем 0,25 мг/кг/день в течение 10–14 дней и т.д. до исчезновения клинических признаков. При обострении состояния – вернуться к предыдущей дозе. Кроме того, может применяться дексаметазон 1 мг/кг, разовая внутригрудная или внутрибрюшинная инъекция.
Циклофосфамид и хлорамбуцил относятся к алкилирующим препаратам. Они ковалентно связываются с ДНК, вызывая «сшивание» и нарушение кодировки.
Циклофосфамид применяют в дозе 50 мг/м2 внутрь каждые 48 часов. В качестве основных побочных эффектов отмечены миелосупрессия в течение 7–14 дней и химический цистит (особенно при продолжительном использовании более 9 недель).
Хлорамбуцил (Лейкеран) применяют в дозе 8 мг/м2 внутрь каждые 48 часов. В качестве основных побочных эффектов отмечены реакции со стороны ЖКТ: рвота, диарея, небольшая лейкопения, кумулятивная гепатотоксичность. Из личного опыта, Лейкеран неплохо переносится кошками, и подобные реакции возникают нечасто. Кроме того, в таблетке Лейкерана 2 мг, и на «среднестатистическую» кошку используется 1 таблетка, что очень удобно в применении;
3) в некоторых иностранных источниках описано применение полипренилфосфатов (Гамапрен, Пренолакт и т.д.), которые подавляют синтез вирусных белков и стимулируют выработку интерферонов. Данные препараты рекомендовано применять 1 мг/кг/день подкожно или 3 мг/кг внутрь, или 3 мг/кг подкожно через день на протяжении 2–3 месяцев;
4) в некоторых иностранных источниках описано применение интерферонов. Рекомбинантный человеческий альфа-интерферон в высоких дозах 10×6 ед/кг временно подавляет признаки заболевания и повышает сроки жизни кошек с FIP. Терапия бесполезна более 2–4 недель. Кошачий интерферон-омега 1 МЕ/кг в полость выпота или внутрь через день, уменьшая частоту лечения до 1 раза в неделю.
Глазное проявление FIP лечится глюкокортикоидами (местными или субконъюнктивальными) и атропином 1%. При невозможности использования местных глюкокортикоидов (например, язвенный кератит) применяются местные НПВС.
Прогноз
Прогноз у кошек с FIP оставляет желать лучшего, несмотря на терапию. У кошек, у которых появились клинические признаки влажного или сухого FIP, прогноз неблагоприятный (99% летальный исход). Выживаемость после начала клинических признаков, как правило, меньше, чем 2 месяца в выпотных случаях, тогда как в «сухих» случаях болезнь имеет более хроническое течение (Addie & Jarrett, 1998). Кошек, у которых развился быстрый, напряженный клеточный иммунитет, вероятнее всего, ждет выздоровление. У таких кошек часто не наблюдается никаких клинических признаков заболевания.
Для того чтобы не допустить развитие FIP-инфекции, нельзя допускать инфекцию FECV. Так как основной путь передачи FECV через фекалии, хорошие условия содержания помогают снизить инфицирование FECV, но зачастую даже в питомниках с превосходными условиями содержания присутствует FECV. Самая оптимальная рекомендация – держать кошек в небольшой популяции (не более 4 животных).
Рекомендация для питомников
- Беременных самок изолируют в патогенсвободную зону так, чтобы их котята и они не контактировали с высокими уровнями FECV.
- Если у кошки титр FIP более 1:100, она может выделять FECV. Ее котята должны быть отлучены в возрасте менее 6 недель. До этого времени материнские антитела защищают котят от заражения FECV.
- Котят выращивают изолированно до 12-16-недельного возраста. Затем их исследуют. Если результаты отрицательные, FECV у них отсутствует. Это сопряжено со сложностями, требует преждевременного отъема, при котором котята переходят в группу риска инфицирования другими заболеваниями, так как они не получают с молоком материнские антитела.
Вакцинация против FIP
Вакцинация была бы вполне логичным решением для защиты котят, однако в настоящее время ценность единственной из доступных на нашем рынке вакцин против FIP – Примуцелла FIP (Pfizer Animal Health) – активно оспаривается. Она представляет собой модифицированный ослабленный живой вирус, который вводится интраназально. Данный вирус чувствителен к колебаниям температуры, поэтому развивается только в сравнительно прохладных областях верхних дыхательных путей. Цель вакцинации – создать иммунитет слизистых оболочек и клеточно-опосредованный иммунитет, причем без синтеза IgG-антител, которые могут усилить сходство с клинической картиной FIP и ускорить развитие заболевания. Эксперименты показали, что данная вакцина является безопасной для кошек как с сероположительной, так и с сероотрицательной реакцией, а ускоренное развитие заболевания встречается лишь в том случае, когда котятам вводятся слишком большие дозы вируса, в то время как для профилактики достаточно небольших доз. Исследование Reeves, 1995 продемонстрировало, что в том случае, когда здоровые котята вначале вакцинируются, а затем помещаются в окружение зараженных сородичей, степень защиты достигает 50–75% (по некоторым исследованиям эффективность составляет 40-80% у котят старше 16 недель, которые еще не были инфицированы FECV (сероотрицательный результат)). Другое исследование продемонстрировало защиту против вируса, аналогичного вирусу вакцины, хотя наши английские коллеги доказали, что эта защита не действует против английского изолята FIP. Исследования, проведенные швейцарскими учеными (Fehr et al., 1995), изучали применение этой вакцины на кошках, хронически инфицированных коронавирусом, и продемонстрировали, что она не обеспечивает защиты против FIP. Вывод, сделанный из этого исследования, гласил, что вакцина Примуцел FIP недостаточно эффективна для кошек, уже инфицированных кишечным коронавирусом кошек, однако обеспечивает определенную степень защиты для кошек с сероотрицательной реакцией. Причем степень этой защиты зависит от географического региона. В эндемичных районах котята инфицируются кишечным коронавирусом в возрасте 6-–7 недель, а данную вакцину не рекомендуется применять до достижения 16-недельного возраста. Ранняя вакцинация рекомендуется Panzero, 1992 в FIP-эндемичных популяциях, однако гарантирована ли при этом безопасность котят, неизвестно. Если в доме нет других кошек, а поэтому вероятность заражения FIP составляет 1:5000, следует исходить из соотношения риск-польза.
Кошки, положительные по FIP (сероположительный результат при наличии клинических признаков)
- В питомниках инфицированных кошек рекомендуется эвтаназировать.
- При заболевании одного животного или небольшой популяции в доме: решение об эвтаназии принимается индивидуально в каждом конкретном случае. Считается, что если другие кошки взрослые, инфицированную кошку изолировать необязательно, так как у взрослых кошек гораздо реже по сравнению с молодыми животными развивается FIP (если только они не контактировали с возбудителем, когда были молодыми, и заболевание не рецидивировало, как описывалось в разделе патогенеза).
Литература
1. Esson D.W. Clinical atlas of canine and feline ophthalmic disease. 2015.
2. Petersen–Jones S., Crispin S. BSAVA Manual of Small Animal Ophthalmology. 2002.
3. Dziezyc J., Millichamp N.J. Color Atlas of Canine and Feline Ophthalmology. 2004.
4. Stades F.C., Wyman M., Boevé M.H., Neumann W., Spiess B. Ophthalmology for the Veterinary Practitioner. 2007.
5. Slatter’s Fundamentals of Veterinary Ophthalmology, Edition 4 ISBN: 978-0-7216- 0561-6 Copyright © 2008, 2001, 1990, 1981 by Saunders, an imprint of Elsevier Inc.
6. Dubielzig R.R., Ketring K., McLellan G.J., Albert D.M. Veterinary Ocular Pathology a comparative review, 2010.
7. Barnett К. Diagnostic Atlas of Veterinary Ophthalmology, 2006.
8. Veterinary ophthalmology. Edited by K.N. Gelatt, B.C. Gilger, T.J. Kern. 5th ed.
9. Atlas of feline ophthalmology. Kerry L. Ketring, Mary Belle Glaze, 1994.
10. Martin C.L. Ocular infections. In: Clinical Microbiology and infectious diseases of the dog and cat. Ed.: C.E. Greene. Philadelphia: W.B. Saunders, 1984.
11. Doherty M. J. Ocular manifestations of feline infectious peritonitis. JAVMA. 1979; 159: 95.
12. Crispin S.M., Mould J.R. Systemic hypertensive disease and the feline fundus. Vet. Ophthalmol. 2001; 4 (2): 131.
13. Stiles J. Ocular manifestations of systemic disease. Part 2: The cat. In: Veterinary Ophthalmology. Ed.: K.N., Gelatt. Philadelphia: Lippincott Williams & Wilkins, 1999.
14. McReynolds C., Macy D. Felineinfectious peritonitis. Part I. Etiology and diagnosis. Comp. Cont. Edu. Pract. Vet. 1997; 19: 1007–1016.
15. Andrew S.E.. Feline infectious peritonitis. Vet. Clin. North Am. Small Anim. Pract. 2000; 30: 987–1000.
16. Rohrbach B.W., Legendre A.M., Baldwin C.A.,et al. Epidemiology of feline infectious peritonitis among cats examined at veterinary medical teaching hospitals. J. Am. Vet. Med. Assoc. 2001; 218: 1111–1115.
17. Hartmann K., Binder C., Hirschberger J., et al. Comparison of different tests to
diagnose feline infectious peritonitis. J. Vet.Intern. Med. 2003; 17: 781–790.
18. Crispin S.M. Uveitis associated with systemic disease in cats. Feline Pract. 1987; 17:16–24.
19. Fischer C.A. Retinopathy in anemic cats. J. Am. Vet. Med. Assoc. 1970; 156: 1415–1427.
20. Lane I.F., Roberts S.M., Lappin M.R. Ocular manifestations of vascular disease:
Hypertension, hyperviscosity and hyperlipidemia. J. Am. Anim. Hosp. Assoc. 1993; 29: 28–36.
21. Erickson P.A., Fisher S.K., Anderson D.H., et al.. Retinal detachment in the cat: The outer nuclear and outer plexiform layers. Invest. Ophthalmol. Vis. Sci. 1983; 24: 927–942.
22. Anderson D.H., Stern W.H., Fisher S.K., et al. Retinal detachment in the cat: The pigment epithelial-photoreceptor interface. Invest. Ophthalmol. Vis. Sci. 1983; 24: 906–926.
23. Anderson D.H., Guerin C.J., Erickson P.A., et al. Morphological recovery in the reattached retina. Invest. Ophthalmol. Vis. Sci. 1986; 27: 168–183.
24. Nell B. Optic neuritis in dogs and cats. Vet. Clin. North Am. Small Anim. Pract. 2008; 38:403–415, VIII.





Назад в раздел

















